| Arbeitsaufträge:
1. Zeichne in ein Koordinatensystem das
Masse-Zeit-Diagramm für das entweichende
Kohlenstoffdioxid-Gas.
|
t [min] |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
m (CO2) [g]
(2) |
0 |
0,98 |
1,38 |
1,54 |
1,58 |
1,60 |
1,62 |
1,63 |
1,63 |
1,64 |
|
n (CO2) [mol]
(3) |
0 |
0,0223 |
0,0314 |
0,0350 |
0,0359 |
0,0364 |
0,0368 |
0,0370 |
0,0370 |
0,0373 |
|
ct(Ca2+) [mol/L]
(4) |
0 |
0,5568 |
0,7841 |
0,8750 |
0,8977 |
0,9091 |
0,9205 |
0,9261 |
0,9261 |
0,9318 |
|
2 nt(H+)umgesetzt
(5) |
0 |
0,0223 |
0,0314 |
0,0350 |
0,0359 |
0,0364 |
0,0368 |
0,0370 |
0,0370 |
0,0373 |
|
nt(H+)Rest
(6) |
0,08 |
0,0577 |
0,0486 |
0,045 |
0,0441 |
0,0436 |
0,0432 |
0,043 |
0,043 |
0,0427 |
|
ct (H3O+)
(7) |
2,0000 |
1,4432 |
1,2159 |
1,1250 |
1,1023 |
1,0909 |
1,0795 |
1,0739 |
1,0739 |
1,0682 |
|
|
|
0,5568 |
0,2273 |
0,0909 |
0,0227 |
0,0114 |
0,0114 |
0,0057 |
0,0000 |
0,0057 |
|
dc(2H+)/dt
(9) |
|
0,5568 |
0,2273 |
0,0909 |
0,0227 |
0,0114 |
0,0114 |
0,0057 |
0,0000 |
0,0057 |
2. Berechne die Stoffmenge nt (CO2)
zu den gegebenen Zeiten.
Für die Molare Masse M gilt:
M(CO2) = 44 g/mol.
Zur Erinnerung: n (CO2) = m (CO2)
/ M (CO2)
3. Ermittle die jeweilige Stoffmengenkonzentration ct
(Ca2+) und ct (H3O+)
in der Lösung. (Hinweis: Beachte die Reaktionsgleichung!
Das
Volumen des festen Marmors spielt keine Rolle!)
4. Zeichne in ein Koordinatensystem das c-t-Diagramm für
die Calcium- und die Oxonium-Ionen.
5. Berechne die mittleren Reaktionsgeschwindigkeiten
v (Ca2+) = Δ
c(Ca2+) / Δ
t für die einzelnen Zeitintervalle und interpretiere die
berechneten Werte!
Diagramm zum Arbeitsauftrag 1:
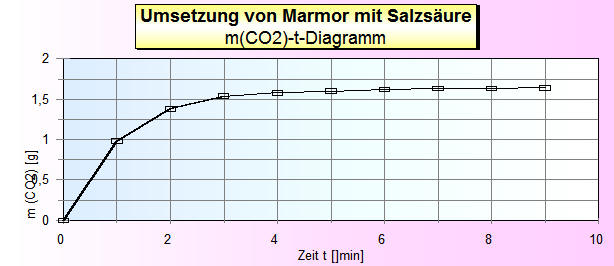
Diagramm zu
den Arbeitsaufträgen 4 und 5:
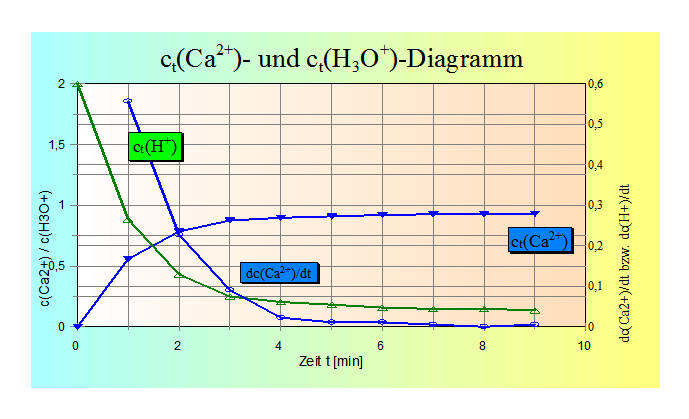
Die Calcium-Ionen nehmen zu, entsprechend
nehmen die Hydronium-Ionen in der Lösung ab.Die mittleren Reaktionsgeschwindigkeiten, auf die Bildung
von Ca-Ionen bezogen, nehmen mit der Reaktionszeit sehr schnell ab, da
die hierzu benötigten Wasserstoffionen sehr schnell verbraucht werden.
Beziehungen zwischen den
verschiedenen Größen:
1. m(CO2) [g] wird mit der Waage gewogen.
Die Werte stehen in Zeile 2.
2. Aus n(CO2) = m(CO2)/M(CO2) errechnen
sich die Werte von n(CO2), die Daten stehen in Zeile 3.
3. Aus der Reaktionsgleichung geht hervor: n(CO2) = n(Ca2+);
zur Erinnerung: CaCO3 (s) + 2 H3O+
(aq)
—> Ca2+ (aq) + 3 H2O (l) + CO2 (g);
oder in
Ionenschreibweise: CO32¯ + 2 H+
-----> CO2 (g) +
H2O(l) und damit: n(CO2) = n(Ca2+)
= 2 n(H+)
Die Konzentration
von Ca2+-Ionen ist dann c(Ca2+) = n /V =
n(Ca2+) / 0,04 L = 0,0223 mol/ 0,04 L = 0,5568 mol/L und
weitere (Zeile 4)
4. Für
jedes Ca2+-Ion, das in Lösung geht, wird ein Molekül CO2
freigesetzt und werden 2 H+-Ionen verbraucht (Zeile 5).
5. Die
Ausgangsmenge an H+-Ionen beträgt bei c(HCl) = 2 mol/L und
V(HCl) = 0,04 L = n(H+) = c * V = 2 mol/L * 0,04 L =
0,08
mol.
Von diesen 0,08
mol werden H+-Ionen als H2-Moleküle freigesetzt, müssen also
abgezogen werden (Zeile 6).
6. Die in
der Lösung verbleibende Konzentration an H+-Ionen ist
in Zeile 7 dargestellt.
7. Die
zeitlichen Änderungen
dc(Ca2+)/dt
sind dann
die Differenzen zwischen dem 2. und 1. Wert (1. Minute und
Versuchsbeginn 0 min) und der Konzentration von Ca2+-Ionen
von 0,5568 mol/L - 0 mol/L = 0,5568 mol/L usw.
8. Wie unter 3.
erwähnt, gilt dann auch
dc(2H+)/dt = dc(Ca2+)/dt
.
Wambach beschreibt die Beziehungen unter den
verschiedenen Größen folgendermaßen:
n0(H3O+)
- nt(H3O+) = 2 nt(Ca2+)
bzw.
nt(H3O+)
= n0(H3O+) - 2 nt(Ca2+)
und daher
ct(H3O+)
= c0(H3O+) - 2 ct(Ca2+),
also hier:
ct(H3O+)
= 2 mol/L - 2 ct(Ca2+) .
Ausgangspunkt ist die Beziehung n(H+)
: n(Ca2+) = 2 : 1, daraus folgt: 2 n(Ca2+)
= 1 n(H+)
|


