Problemstellung:
Wie stellt sich der Zusammenhang zwischen
Reaktionsgeschwindigkeit und Konzentrationen der Ausgangsstoffe dar,
wenn diese in gleichen oder ähnlichen Konzentrationen vorliegen?
Vermutung:
Der Geschwindigkeitsverlauf der Reaktion wird
nicht ausschließlich von der Konzentration eines Ausgangsstoffes A oder
B bestimmt, sondern die Konzentrationsänderungen beider
Ausgangsgangsstoffe beeinflussen die Reaktionsgeschwindigkeit.
Vorüberlegung: Ethanol und
Essigsäure reagieren zu Essigsäureethylester und Wasser
Eigenschaften des Reaktionsprodukts Ester:
1. ____________________________________________________________________
Vorversuch: Verseifung von Essigsäureethylester durch
Natronlauge
Geräte und
Chemikalien: Spannungsquelle (0-10 V), Amperemeter, Voltmeter,
Leitfähigkeitselektrode, Verbindungskabel, Rggl., Bechergläser, Brenner,
Pipette, Natronlauge c(NaOH) = 2 mol/L, Phenolphthalein, aqua dest.
[Alternativ dazu kann ein geeichtes Leitfähigkeitsmessgerät verwendet
werden]
Durchführung: In einem Rggl. werden 10 mL aqua dest., 1 mL
Natronlauge und 3-4 Tropfen Phenolphthalein gemischt. Die Stromstärke
[Leitfähigkeit]
dieser Lösung wird bei U = 1 V ~ bestimmt und notiert. Danach wird 1 mL
Ester hinzugefügt, geschüttelt und im Becherglas mit 70 °C warmem Wasser
erwärmt.
|
Beobachtungen:
1.
__________________________________________________________________________________ |
2.
__________________________________________________________________________________ |
Nach dem Erwärmen wird
auf Zimmertemperatur abgekühlt und die Stromstärke bestimmt.
Versuchsergebnisse: 1. Die Anfangsstromstärke I0
beträgt 120 mA, die Endstromstärke IEnde beträgt 30mA.
[Die Anfangsleitfähigkeit
c0
beträgt 5,2 mS, die Endleitfähigkeit cEnde
= 2,0 mS]
Fragestellung:
Wie lassen
sich die unterschiedlichen Stromstärken zu Beginn und am Ende des
Versuchs erklären? |
| Ionenleitfähigkeit
bei 25 °C: |
| OH-: 174 S*cm2/mol |
| CH3COO-: 34,5 " |
| Na+: 43,5 " |
|
|
Hauptversuch:
Geräte und Chemikalien:
Spannungsquelle (0-15 V), Erlenmeyerkolben 125 mL, Kristallisierschale als
Thermostatgefäß, Magnetrührer, Thermometer, Amperemeter, Voltmeter,
Stoppuhr, Elektroden, Messzylinder, [geeichtes Leitfähigkeitsmessgerät
mit Messzelle] Essigsäureethylesterlösung mit c = 0,1 mol/L,
Natronlauge mit c = 0,1 mol/L, Natriumacetatlösung mit c = 0,025 mol/L.
Durchführung:
Alle Lösungen werden auf
Zimmertemperatur gebracht.
A
) Bestimmung der
Anfangsstromstärke I0 (bei U=2 V~): In den Erlenmeyerkolben werden 25
mL der Natronlauge mit c=0,1 mol/L und 75 mL aqua dest. gegeben. In diesem
Gemisch besitzt die Natronlauge die gleiche Konzentration und erzeugt die
gleiche Leitfähigkeit wie im Reaktionsgemisch zu Beginn des Hauptversuchs.
Stromstärke und Temperatur werden notiert. |
|
|
B)
Hauptversuch:
In das gespülte Reaktionsgefäß gibt
man 25 mL der Natronlauge mit c=0,1 mol/L, 50 mL aqua dest. und stellt
den Rührer an. Nun werden schnell 25 mL der Esterlösung dazugegeben, die
Stoppuhr in Gang gesetzt und der Anfangsstromstärkenwert notiert. In
Abständen von 1 min werden 20 min lang die Stromstärken notiert. |
C) Bestimmung der Endstromstärke:
Aufgrund der langen Reaktionsdauer kann
die Endstromstärke erst am nächsten Tag abgelesen werden. Da sie sich
jedoch ausschließlich aus der Ionenleitfähigkeit der Natrium- und
Acetationen zusammensetzt, kann zu ihrer Bestimmung auch eine
Natriumacetatlösung herangezogen werden.
[Die gleiche Versuchsanordnung und
-durchführung kann auch mit einem Leitfähigkeitsmessgerät gefahren werden.
Im weiteren Textverlauf wird nur noch auf die Stromstärke Bezug
genommen] . |
Beobachtungen:
Messwerttabelle: I0 = 25,5
mA bei 22 °C
Auswertung:
1. Die Stromstärke wird gegen die Zeit
aufgetragen. An 5 Stellen wird die Normale eingezeichnet.
2. Welcher Konzentration entspricht die
Anfangsstromstärke I0?
I0 = c (_______________)
3. Welcher Konzentration entspricht die
Endstromstärke IEnde?
IEnde = c (_______________) |
|
t[min] |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
I[mA] |
25,5 |
23,8 |
22,4 |
21,2 |
20,2 |
19,4 |
18,8 |
18,2 |
17,6 |
17,2 |
16,8 |
|
t[min] |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
Ende |
|
I[mA] |
16,4 |
16,3 |
15,7 |
15,4 |
15,2 |
15,0 |
14,7 |
14,5 |
14,3 |
14,1 |
10 |
|
4.
Der Bereich zwischen Anfangs- und Endkonzentration wird
in 5 gleiche Abschnitte von ____________ mol/l
unterteilt. Auf diese Weise lassen sich die
Momentankonzentrationen an den Schnittpunkten der
Normalen mit der Kurve ablesen.
5. Es wird überprüft, ob die Verseifung
(alkalische Hydrolyse) von Essigsäureethylester eine
Reaktion 1.Ordnung ist.
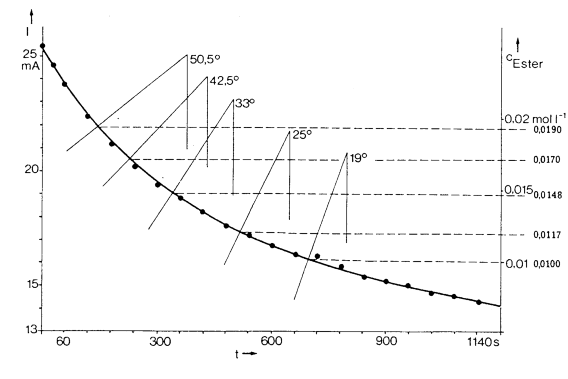
Die
Stromstärke-Zeit-Kurve zeigt die
nebenstehende Abbildung. Aus ihr wird deutlich, wie die
Momentankonzentrationen auf graphischem Wege ermittelt
werden können bei einem Maßstabsverhältnis von 0,01
mol/375 s = 2,67*10-5
mol/L*s-1. Trägt man nun v gegen c(Ester)
auf, so erhält man keine lineare Beziehung. Das
Geschwindigkeitsgesetz kann somit auch nicht v = k *
c(Ester) lauten. Die
anfangs aufgestellte Vermutung, dass die Geschwindigkeit
nicht nur von der Konzentration eines Ausgangsstoffes
abhängt, wird also bestätigt. Da die Konzentration an OH--Ionen
mit Fortschreiten der Reaktion genauso abnimmt wie die
Konzentration des Esters (siehe Reaktionsgleichung),
wäre auch folgende Beziehung denkbar: v = k * c(Ester) *
c(Lauge). Da beide Stoffe in derselben
Ausgangskonzentration vorliegen, vereinfacht sich der
Ausdruck zu v = k*c2 . |
 |
|
|
|
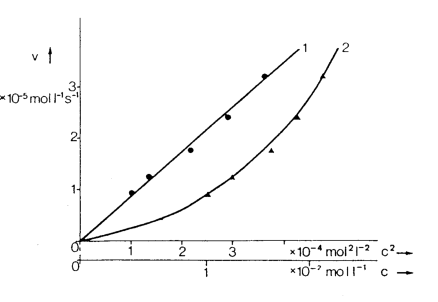
Die Beziehung wird
überprüft, indem man v gegen c2
aufträgt. In der Abbildung sind beide Funktionen: v = k * c
(Kurve 2) und v = k * c2 (Kurve 1) graphisch
dargestellt. Nur zwischen der Geschwindigkeit und dem Produkt
der Konzentrationen der beiden Ausgangsstoffe besteht ein
linearer Zusammenhang, die Verseifung von Essigsäureethylester
ist somit eine Reaktion 2. Ordnung. Das heißt: die
Reaktionsgeschwindigkeit ist von der Konzentration zweier
Ausgangsstoffe abhängig.
|
|
c [mol/L] |
a [°] |
RG [mol/L*s] |
| 0,0100 |
19,0 |
0,92*10-5 |
| 0,0117 |
25,0 |
1,24*10-5 |
| 0,0148 |
33,0 |
1,73*10-5 |
| 0,0170 |
42,5 |
2,44*10-5 |
| 0,0190 |
50,5 |
3,23*10-5 |
|
|
Die Geschwindigkeitskonstante wird aus der Steigung der
Geraden ermittelt:
tan 41° = 0,87 ;
k = 0,87 * 0,1 l * mol-1
* s-1 = 8,7*10-2
l * mol-1 * s-1
Die Dimension der
Geschwindigkeitskonstanten ergibt sich aus dem
Geschwindigkeitsgesetz.
|
 |
|
Lösungen:
siehe dazu:
Anleitung zu Auswertung des Versuchs zur
Alkalischen Esterhydrolyse
und
Bestimmung der
Geschw.-konstanten der
Alkalischen
Esterhydrolyse
Quelle:
Nach Jansen/Ralle/Peper: Reaktionskinetik
und chemisches Gleichgewicht, Aulis-Verlag Köln, 1986
update am
02.02.2021
zurück
zur Hauptseite
|


