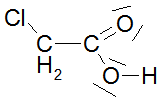|
||||||||||||||||||||||||||||||||||||||||||||||||||||
Säurestärke einiger Carbonsäuren (II) |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Die in der Tabelle aufgeführten Carbonsäuren zeigen in wässrigen Lösungen der
Konzentration c = 1 mol/L die genannten pH-Werte:
Bei Oxalsäure, Malon- und Bernsteinsäure gibt es zwei pKs-Werte. Warum? Aufgabenstellung:
Welche Zusammenhänge gibt es zwischen Struktur und
pH- bzw. pKs-Wert?
Erläutere detailliert für alle vier Gruppen von Carbonsäuren! |
Lösungen:
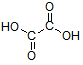
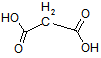
Bei Oxal-, Malon- und Bernsteinsäure gibt es zwei pKs-Werte: weil alle drei Verbindungen Dicarbonsäuren sind. Aufgabenstellung:
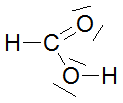
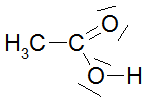
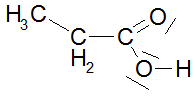
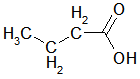
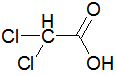
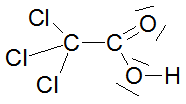
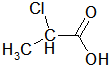
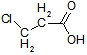
Bei den ersten drei bzw. vier Carbonsäuren ist zu erkennen, dass der pKs-Wert mit zunehmender Kettenlänge der Alkylgruppe zunimmt, was am +I-Effekt (positiver induktiver Effekt) der Alkylgruppen liegt. Der Unterschied zwischen C3 und C4 ist marginal, im übrigen nimmt ja der +I-Effekt ab C3 sowieso ab. Alkylgruppen schwächen also die Säurestärke ab. Die drei Chloressigsäuren zeigen sehr schön, dass mit zunehmender Cl-Atom-Anzahl der pKs-Wert abnimmt, was am -I-Effekt der Cl-Atome liegt. Die pks- bzw. pH-Änderungen sind nicht marginal. -I-Effekt-Gruppen verstärken also die Säurestärke. Ebenso schön zeigt der Unterschied zwischen 2- und 3-Chlor-propionsäure, dass mit zunehmender Entfernung des Cl-Atoms von der Carboxygruppe der Einfluss ebendieses Cl-Atoms abnimmt: je weiter weg vom Reaktionszentrum, desto geringer der Effekt. Der pKs-Wert nimmt zu, also die Säurestärke ab. Dieses Verhalten zeigen auch die drei Dicarbonsäuren, bei denen jede Carboxygruppe von der anderen beeinflusst wird. Je größer die Entfernung zwischen zwei Gruppen wird bzw. ein die Säurestärke dämpfender Effekt von CH2-Gruppen dazukommt, desto geringer die pKs-Werte. Dabei ist der Unterschied zwischen den beiden letzten Carbonsäure in der 2. Dissoziationsstufe marginal. Alle Beispiele zeigen fast idealtypisch den Einfluss und die Wirkungsweise von Gruppen mit -I- und +I-Effekten und die Bedeutung der Entfernung zwischen Einfluss nehmender Gruppe und Reaktionszentrum (Carboxylgruppe) auf. |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
update am 02.02.2021 zurück zur Hauptseite |