| 1. |
Verbindung des Kohlenstoffs mit Wasserstoff
und Sauerstoff;
Besonderheit: C=O-Doppelbindung
|
| 2. |
Nachweis
der funktionellen Gruppe „Ketogruppe":
nicht mit Fehling I+II, Tollens-Reagenz, Schiff‘sche Reaktion, sondern
mit speziellen Additions- und Reduktionsreaktionen |
| 3. |
Homologe
Reihe: Propanon, Butanon, Pentanon usw. |
| 4. |
Je größer die C-Zahl, desto mehr Isomere
gibt es.
|
| 5. |
Die Isomere lassen sich in zwei Subgruppen einteilen:
Verzweigte und endständige Ketone; |
| 6. |
Wesentliche Eigenschaften:
Siedepunkt, Schmelzpunkt, Wasserlöslichkeit, chemische Reaktionen (Additionsreaktionen) |
| 7. |
Siedepunkt, Schmelzpunkt und Wasserlöslichkeit werden von der Art der
zwischenmolekularen Bindungskräfte (Sekundärbindungskräfte)
bestimmt: |
| |
| hydrophob/lipophil |
|
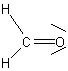
hydrophil/lipophob |
|
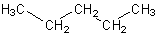
|
|
|
|
Sekundärbindungskräfte:
Van-der-Waals-Kräfte (VdWK) |

|
Sekundärbindungskräfte:
Dipol-Dipol-Bindung |
|
Sekundärbindungskräfte:
VdWK und Dipol-Dipol-Kraft |
Wasserlöslichkeit:
fördernd: WBB
hemmend: VdWK mit zunehmendem KW-Rest |
|
|
|
|
8. |
Das Keton ist der Kompromiss zwischen dem
unpolaren Alkan und dem
polaren Methanal, mit der Einschränkung, dass zwei H-Atome bereits durch
Methylgruppen ersetzt sind und entsprechend die Polarität erheblich
geringer ist.
- je nach Länge des Kohlenwasserstoff-Restes entscheidet der unpolare oder
der polarere Teil des Moleküls
- je nach Struktur des KW-Restes ist der unpolare Teil stärker oder
schwächer: der Verzweigungsgrad entscheidet darüber: je verzweigter, desto
weniger wirken die VdWK.
- Siedepunkte/Schmelzpunkte: hier wirken Dipol-Dipol-Bindung und Van-der-Waals-Kraft zusammen, bei der
Wasserlöslichkeit wirken Wasserstoffbrückenbindung zwischen dem/den freien
Elektronenpaar/en des doppelt gebundenen Sauerstoffatoms der Keto-Gruppe und
den H-Atomen des Wassermoleküls und
VdWK gegeneinander. |
|
9. |
Oxidierbarkeit: Ketone –> CO2
: keine weitere Oxidationsmöglichkeit mehr außer
Totaloxidation |