|
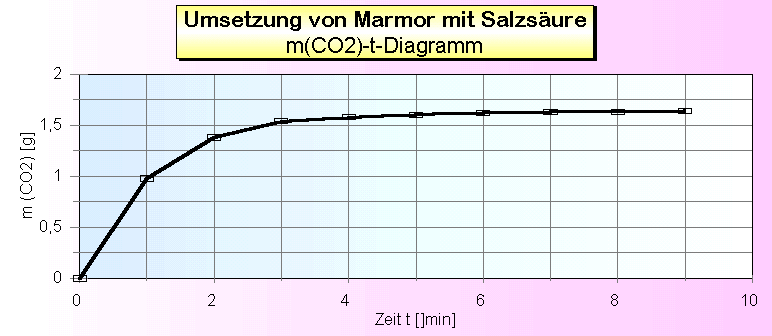
Umsetzung von Marmor mit Salzsäure 1. Versuchsdaten und Masse-Zeit-Diagramm
2. Stoffmenge n(CO2) [mol]
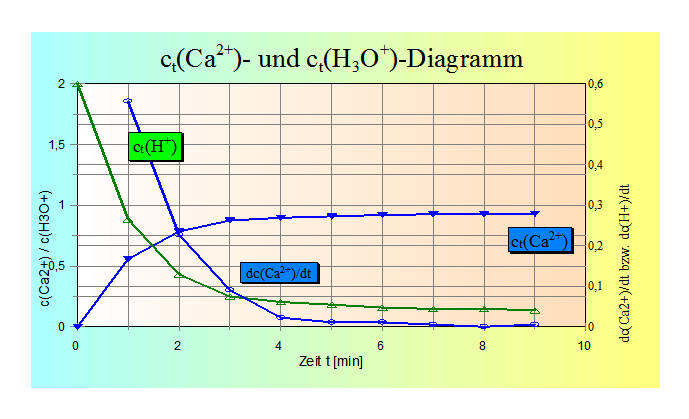
Die Stoffmenge n(CO2) errechnet sich als n(CO2) = m(CO2) / M(CO2) [mol] 3. Stoffmengenkonzentration c (Ca2+) und c(H3O+) mit V(Lösung) = 0,04 l
Beziehungen zwischen den
verschiedenen Größen: oder in Ionenschreibweise: CO32¯ + 2 H+ -----> CO2 (g) + H2O(l) und damit: n(CO2) = n(Ca2+) = 2 n(H+) Die Konzentration von Ca2+-Ionen ist dann c(Ca2+) = n /V = n(Ca2+) / 0,04 L = 0,0223 mol/ 0,04 L = 0,5568 mol/L und weitere (Zeile 4) 4. Für jedes Ca2+-Ion, das in Lösung geht, wird ein Molekül CO2 freigesetzt und werden 2 H+-Ionen verbraucht (Zeile 5). 5. Die Ausgangsmenge an H+-Ionen beträgt bei c(HCl) = 2 mol/L und V(HCl) = 0,04 L = n(H+) = c * V = 2 mol/L * 0,04 L = 0,08 mol. Von diesen 0,08 mol werden H+-Ionen als H2-Moleküle freigesetzt, müssen also abgezogen werden (Zeile 6). 6. Die in der Lösung verbleibende Konzentration an H+-Ionen ist in Zeile 7 dargestellt. 7. Die zeitlichen Änderungen dc(Ca2+)/dt sind dann die Differenzen zwischen dem 2. und 1. Wert (1. Minute und Versuchsbeginn 0 min) und der Konzentration von Ca2+-Ionen von 0,5568 mol/L - 0 mol/L = 0,5568 mol/L usw. 8. Wie unter 3. erwähnt, gilt dann auch dc(2H+)/dt = dc(Ca2+)/dt . Graphische Umsetzung:
update am: 30.01.21 zurück zur Hauptseite |