|
Chemie-Arbeitsblatt _ _ Klasse _ _ _ Name
_______________________________Datum _ _ ._ _._ _ |
Leitfähigkeitstitration
Die Konzentration von sauren oder
basischen Lösungen kann man dann mittels Titration mit einem Indikator
als Endpunktsanzeiger gut bestimmen, wenn die Indikatorfarbe selbst
deutlich erkennbar ist. Dazu muss die vorgelegte saure-/alkalische Lösung
möglich farblos sein. In durch Farbstoffe gefärbten Lösungen wie
z.B. CocaCola oder Fruchtsäften ist der Umschlagspunkt eines Indikators
jedoch nicht erkennbar. Zur Bestimmung der Konzentration geht die
Chemische Analytik einen anderen Weg: Saure Lösungen sind durch eine hohe
Konzentration von Hydronium-Ionen H3O+
gekennzeichnet. Die H3O+-Ionen und ihre
entsprechenden Säurerest-Anionen bewirken als Ladungsträger eine elektrische
Leitfähigkeit: Bei einer bestimmten angelegten konstanten Spannung
setzt die Lösung dem fließenden Strom einen bestimmten Widerstand
entgegen. Je größer die Ionenkonzentration, desto geringer der
Widerstand und desto größer die Leitfähigkeit. Im Laufe der Titration
reagieren die H3O+-Ionen mit den Hydroxid-Ionen der
zugesetzten Lauge. Dabei entsteht Wasser: nicht leitend. Und es kommen Na+-Ionen
in die Lösung. Deren Leitfähigkeit ist jedoch erheblich schlechter als
die der H3O+-Ionen, während die Leitfähigkeit der
OHG-Ionen vergleichbar der der
Hydronium-Ionen ist. Also wird im Laufe einer Leitfähigkeitstitration die
Leitfähigkeit abnehmen und nach Erreichen des Äquivalenzpunktes wieder
zunehmen. Folgende Versuche sollen die Anwendung der
Leitfähigkeitstitration erläutern:
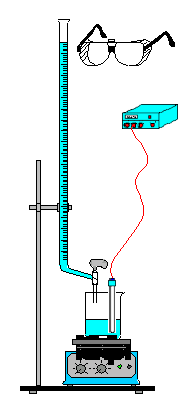
Versuch
1: In einem hohen Becherglas (200 ml) werden 100 ml
Salzsäure der Konzentration c(HCl) = 0,01 mol/L vorgelegt. Die
Bürette wird mit Natronlauge der Konzentration c(NaOH) = 0,1
mol/L aufgefüllt. Mit dem LF-Messgerät wird die
Anfangs-Leitfähigkeit bestimmt. Danach wird jeweils 1 ml Natronlauge
zugegeben, einige Sekunden gewartet und der geänderte Messwert abgelegen
und notiert. Nach der Zugabe von 17 ml Natronlauge wird der Versuch
beendet.
Versuch
2: Von gesättigter Bariumhydroxid-Lösung Ba(OH)2 (aq)
werden 25 ml mit dem Messzylinder abgefüllt und im hohen Becherglas auf
100 ml verdünnt. Die Lösung wird in der gleichen Versuchsanordnung wie V1
mit |
 |
| Schwefelsäure
der
Konzentration c(H2SO4) = 0,1 mol/L titriert.
Die Leitfähigkeit wird wie in Versuch 1 vor und nach jeder Zugabe
gemessen. |
|
Versuch 3:
Essigsäure-Lösung
der Konzentration
c(CH3COOH) = 0,1
mol/L wird mit Natronlauge der Konzentration
c(NaOH) = 1 mol/L
titriert.
Vorgelegt werden 100 ml Essigsäure. Zusätzlich wird
Phenolphthalein
als
Indikator eingesetzt. Gemessen wird wie in Versuch 1.
Versuch 4:
Von Aceto balsamico
werden 10 ml im Titriergefäß auf 100 ml
verdünnt und wie in Versuch 1 mit Natronlauge
der Konzentration
c(NaOH) = 1 mol/L
titriert. |
Arbeitsaufträge
zur Auswertung:
1. Notiere die Versuchswerte im entsprechenden Datenblatt.
2. Vergleiche die Beobachtungen von
Versuch 1 und 2.
3. Erstelle ein Diagramm aus den Versuchswerten: x-Achse:
zugeführte Lauge bzw. Säure in [ml], y-Achse: Leitfähigkeit in [mS/cm].
Skaliere die Achsen in der Weise, dass pro Graphik ein (1) DIN-A4-Blatt
möglichst gut ausgenützt wird.
4. Ermittle für jedes Diagramm den Äquivalenzpunkt graphisch
durch Extrapolation als Schnittpunkt der beiden Geraden.
5. Berechne zu
Versuch 2 die Konzentration der
Bariumhydroxid-Lösung und in
Versuch
4 die Konzentration der Essigsäure
in Aceto balsamico.Quelle:
Tausch, v. Wachtendonk: Chemie 2000+, Band 2, Bamberg
2004
|
|
Lösungen: |
Arbeitsaufträge zur Auswertung: |
|
1. Notiere die Versuchswerte im entsprechenden Datenblatt.
Siehe dazu:
Datenblatt
"Auswertung der Leitfähigkeitsversuche" |
|
2. Vergleiche die Beobachtungen
von
Versuch 1 und 2.
In beiden Versuchen ergeben sich die Äquivalenzpunkte
graphisch durch den Schnittpunkt der geraden Kurvenabschnitte. In
Versuch 1
(Salzsäure und Natronlauge) sinkt die Leitfähigkeit nicht auf Null, da
die leitfähigen Na- und Chlorid-Ionen gelöst bleiben. In
Versuch 2
sinkt die Leitfähigkeit auf Null, da das entstehende Bariumsulfat nur
eine sehr geringe Löslichkeit hat. |
|
3. Erstelle ein Diagramm
aus den Versuchswerten: x-Achse:
zugeführte Lauge bzw. Säure in [ml], y-Achse: Leitfähigkeit in [mS/cm].
Skaliere die Achsen in der Weise, dass pro Graphik ein (1) DIN-A4-Blatt
möglichst gut ausgenützt wird. Siehe dazu:
Datenblatt
"Auswertung der Leitfähigkeitsversuche" |
|
4. Ermittle für jedes Diagramm den
Äquivalenzpunkt graphisch
durch Extrapolation als Schnittpunkt der beiden Geraden.
Siehe dazu:
Datenblatt
"Auswertung der Leitfähigkeitsversuche"
|
|
5. Berechne zu
Versuch 2 die
Konzentration der
Bariumhydroxid-Lösung und in
Versuch
4 die Konzentration der Essigsäure
in Aceto balsamico.
Versuch 2:
Nach dem bisher bekannten
Säure-Base-Titrationsverfahren muss n(Säure) = n(Base) sein. Die
Molzahl n ist das Produkt aus Konzentration c [mol/L] und
Volumen V [l]. Berechne - soweit aus den angegebenen
Versuchsdaten ersichtlich - die Äquivalenzpunkte bzw. die fehlenden
Daten auf der Basis der Beziehung n(Säure) = n(Base)!
n(Säure) = n(Base)
Bariumsulfat-Schwefelsäure
c(S) * V(S) =
c(B) * V(B)
Gegeben: V(S) = experimentell,
c(S) = 0,1 mol/L,
V(B) = 0,1 l
Gesucht: c(B) = experimentell
c(B) = c(S) * V(S) / V(B) = 0,1 mol/L * 0,015 l / 0,1
l = 0,015 mol/L
Da die Ausgangslösung 25 mL betrug und auf 100 mL verdünnt wurde, ist
die Ausgangskonzentration vier-fach so hoch, also 4* 0,015 mol/L =
0,06 mol/L.
Versuch
4:
n(Säure) = n(Base)
Essigsäure - Natronlauge
c(S) * V(S) = c(B) * V(B)
Gegeben: V(S) = 0,1 L,
V(B) = experimentell c(B) = 1 mol/L
Gesucht: c(S) = experimentell
c(S) = c(B) * V(B) / V(S) ; c(S) = 1 mol/L * ..... l / 0,1 L
= _____________ mol/L
Die Konzentration von handelsüblichem Aceto balsamico beträgt ca. 6%,
dies entspricht etwa einer Konzentration c(Säure) von 1 mol/L. Für die
Titration von10 mL Essig benötigt man also ca. 10 mL Natronlauge mit
c(NaOH) = 1 mol/L (Angaben nach Lehrerhandbuch Chemie 2000+ Band 2)
| erstellt am:
02.02.21
zurück
zur
Hauptseite |
|
