|
Lösungen: |
| Arbeitsaufträge: |
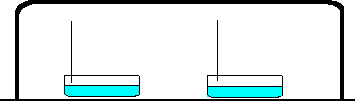
| V1: Beobachtung: Aus
Chlorwasserstoff- und Ammoniakgas bildet sich unter der Glasschale ein dicker,
weißer Rauch. Erklärung: Es bildet sich das Salz Ammoniumchlorid in Form weißer, winziger Kristalle an der Glaswand. Reaktionsgleichung: NH3(g) + HCl(g) ----> NH4Cl(s) |
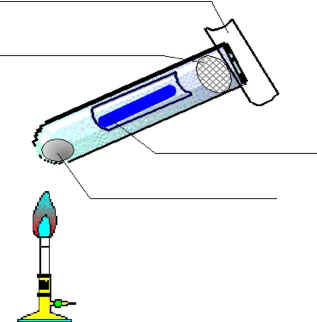
| V2: Das untere Indikatorpapier färbt sich rot, das obere blau.Erklärung: Ammoniumchlorid spaltet sich beim Erhitzen auf in die Gase Chlorwasserstoffgas und Ammoniak. Der untere Teil färbt sich rot, also saure Reaktion, also Hinweis auf Chlorwasserstoffgas, der obere Teil färbt sich blau, also alkalische/basische Reaktion, also Ammoniak. Die Ammoniak-Moleküle sind wegen ihrer geringeren molaren Masse leichter und beweglicher.Reaktionsgleichung: NH4Cl(s) ----> NH3(g) + HCl(g) |
| V3: Reaktionsgleichung: CuO(s) + 2
HCl(aq) ---- > H2O(l) +
CuCl2(s) Erklärung: Oxoniumionen aus der Salzsäure H3O+(aq) reagieren mit Oxid-Ionen O2¯ zu H2O: 2 H3O+(aq) + O2¯ ----> H2O(l) Zunächst hydratisierte Cu2+- und Cl¯-Ionen reagieren zu festem, kristallinem CuCl2(s): Cu2+(aq) + 2 Cl¯(aq) ----> CuCl2(s) + H2O(l) |
|
1. Beschriftung der Skizze: linke Schale: konz. Ammoniak-Lösung, rechte Schale: konz. Salzsäure 2. Erkläre die
Tatsache, dass Ammoniumchlorid ein kristalliner Feststoff ist. Ammonium- und Chlorid-Ionen ordnen sich zu einem kristallinen
Gitter an. |
| 3. Wie könnte man nachweisen, dass
in dem Rauch aus V1 tatsächlich Chlorid-Ionen enthalten sind? Durch Reaktion des Rauchs mit Silbernitrat-Lösung: Bildung
eines weißen Niederschlags, der in verd. Ammoniak-Lösung löslich
ist |
| 4. Nenne bei den
Versuchen 1 und 2 jeweils die Säure und die Base!
V1: Säure HCl(g) Base: NH3(g) V2: Säure NH4+ Base: Cl¯ |
| 5. Welches
der beiden Gase entweicht schneller aus dem Reagenzglas!
Erkläre! Die Ammoniak-Moleküle sind wegen ihrer geringeren molaren Masse leichter und beweglicher, entweichen also schneller aus dem Reagenzglas. |
| 6. Leitet die
grüne Lösung aus V3 den elektrischen Strom? Weil sie Ionen enthält, leitet sie den elektrischen Strom. |
| 7. Schwarzes
Kupferoxid würde auch mit Chlorwasserstoffgas zu
Kupferchlorid reagieren. Formuliere das
Reaktionsschema zwischen dem Protonenakzeptor und dem Protonendonator! Reaktionsschema: 2 HCl(g) + O2¯ ----> H2O(l) + 2 Cl¯(aq) Säure Base |
| 8. Wer ist der bessere
Protonenakzeptor: das Hydroxid-Ion oder das Oxid-Ion?
Begründe! Aufgrund der zweifach negativen Ladung ist das Oxid-Ion der bessere Protonenakzeptor. |
|
Siehe dazu auch
Brönsted-Lowry-Konzept
der Säuren und Basen (III) im pdf-Format und
Brönsted-Lowry-Konzept der
Säuren und Basen (III) (zip-Datei) im
WordPerfect-Format. |