|
||
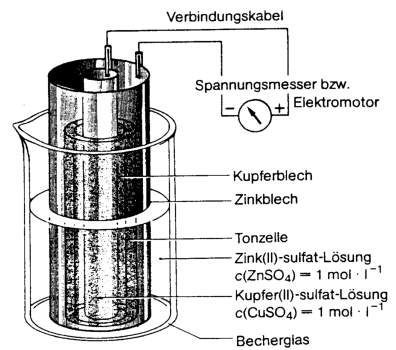
Das Daniell-Element |
||
|
Versuch 1: Die beiden Metalle werden über Verbindungskabel und Krokodilklemmen mit einem hochohmigen Spannungsmessgerät verbunden. Statt dem Voltmeter kann auch ein Kleinstelektromotor angeschlossen werden. Beobachtungen:_____________________________________________________________________________________ ___________________________________________________________________________________________________________ ____________________________________________________________________________________________________________ |
 |
|
|
Arbeitsaufträge:Arbeitsaufträge:
1. Fertige eine
Übersichtskizze anFertige eine
Übersichtskizze an Versuch 2: In ein U-Rohr mit einem Diaphragma in der Mitte werden in den einen Schenkel eine Zink-Stange (Zink-Elektrode), in den anderen Schenkel eine Kupfer-Stange (Kupfer-Elektrode) gesteckt. Die Schenkel sind mit verdünnter Schwefelsäure gefüllt. Beobachtungen: _____________________________________________________________________________________ _______________________________________________________________________________________________________________ ______________________________________________________________________________________________________________ ______________________________________________________________________________________________________________
Arbeitsaufträge: |
|
|
|
Lösungen:: |
|
Beobachtungen zu
Versuch 1: Der Elektromotor läuft, am Spannungsmessgerät kann eine Spannung von 1,1 V abgelesen werden. Arbeitsaufträge zu Versuch
1:
3. Welche Metallplatte
übernimmt dann welche Funktion?
Elektronendonator/Elektronenakzeptor? 4. Welche Funktion hat
die Tonzelle? Welche Materialien können vergleichbar
funktionieren? 5. Welche
Einzelreaktionen spielen sich in den jeweiligen Lösungen ab? 6. Welche Rolle spielt
die Größe der Oberfläche der Metalle? 7. Welche Faktoren
bestimmen die Dauer des Versuchs?
8..Wie wird eine
solche Versuchsanordnung als Gesamtsystem formal dargestellt?Wie wird eine
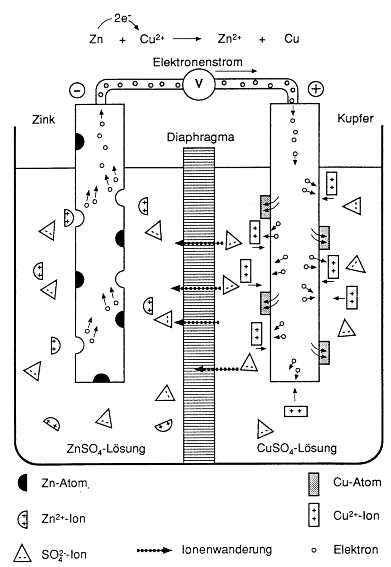
solche Versuchsanordnung als Gesamtsystem formal dargestellt? 9. Beschreibe die
Vorgänge in der nebenstehenden Abbildung! Beobachtungen zu Versuch 1: Zunächst beobachtet man eine Spannung von ca. 1,1 V. Werden die Elektroden leitend miteinander verbunden, etwa durch Benutzung eines Kleinstmotors, sinkt die Spannung auf ca. 0,7 V ab. An beiden Elektroden kann man eine Gasentwicklung beobachten. Arbeitsaufträge: 11. Welche
Unterschiede gibt es zu Versuch 1? Während Zink nach wie vor als "unedles" Metall Elektronen nach dem bekannten Schema abgibt , spielt sich auf der anderen Seite die Reaktion 2 H3O+(aq) + 2 e ̵ ---> H2(g) + 2 H2O(l) an der Kupferoberfläche ab. Da das Redoxpaar Cu/Cu2+ in der Spannungsreihe "unterhalb" des Redoxpaares H2(g)+2 H2O(l)//2 H3O+(aq) steht, spielt sich hier keine Redoxreaktion ab. Die Kupferoberfläche leitet die Elektronen lediglich weiter an die Wasserstoffionen. Allein zwischen dem Redoxpaar Zn/Zn2+und dem Paar Wasserstoff/Wasserstoffionen kommt es also zu einem Elektronenaustausch. Da das Redoxpaar Zn/Zn2+ "unedler", weil "höher" in der Spannungsreihe, stellt es das Elektronendonatorensystem dar, während Wasserstoffionen zu Wasserstoffgas entladen werden (Elektronenakzeptorsystem). Die an der Zink-Seite entstehenden Wasserstoffionen entstammen der Reaktion des unedlen Metall mit einer verdünnten Säure, eben nach dem Reaktionsschema 2 H3O+(aq) + 2 e ̵ ---> H2(g) + 2 H2O(l). Die dabei gebildeten Zink-Ionen finden auf der Kupferseite kein "metallisches" Gegenstück, weil eben aus den genannten Gründen der Spannungsreihe das Metall Kupfer nicht mit verdünnter Schwefelsäure reagiert. Der Ladungsausgleich findet also mit Wasserstoffionen statt.
|
|
update: 15.02.21 zurück zur Hauptseite |