| Beobachte genau den Versuchsverlauf in beiden
Versuchen, besonders die zeitlichen Unterschiede in der
Entfärbung und notiere genau die Beobachtungen.
Versuch 1:
Bei der
Bestrahlung durch den blauen
Lichtfilter erfolgt die Entfärbung schneller als bei der
Bestrahlung durch den
roten Filter.
|
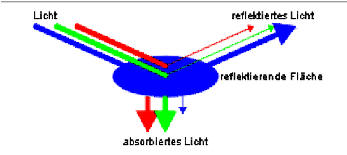
Durch die blaue Folie
erfolgt eine starke
Reflexion von Blau und eine Absorption
von Grün und Rot.
Absorption von 500 - 560 nm = 239 - 213 kJ: grün
Absorption von 605 - 750 nm = 197 - 159 kJ: rot
Reflexion von 435 - 480 nm = 274 - 248 kJ: blau |
 |
|
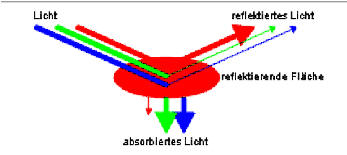
Durch die rote
Folie erfolgt eine
starke Reflexion von Rot und eine
Absorption von Grün und Blau.
Absorption von 500 - 560 nm = 239 - 213 kJ: grün
Absorption von 435 - 480 nm = 274 - 248 kJ: blau
Reflexion von 608 - 750 nm = 197 - 159 kJ: rot |
 |
Die
meisten Lichtquanten aus dem Bereich des
roten Lichts mit einer Energie von 197 - 159
kJ/mol reichen nicht aus, um die Bindung im Br2-Molekül
mit einer
Bindungsenergie von 193 kJ/mol zu trennen.
In der
Gasphase ist ein Gas enthalten, das beim Test mit konz.
Ammoniak-Lösung einen weißen Rauch bildet und einen
angefeuchteten Indikatorpapierstreifen rot färbt. Es ist
Bromwasserstoff HBr(g), das in Wasser gelöst als Säure reagiert
und mit Ammoniak festes Ammoniumbromid bildet.
Bei
Versuch 2:
verläuft die Entfärbung der Probe, der ein Jod-Kristall
hinzugefügt wurde, viel langsamer als bei der Probe ohne Jod.
Iod wirkt bei der Bromierung von Alkanen als
Inhibitor,
weil im ersten Schritt der Kettenreaktion gebildete
Alkylradikale mit Iod-Molekülen reagieren. Die dabei
gebildeten Jod-Radikale sind so wenig reaktiv, d.h. so
stabil, dass sie die Kettenreaktion nicht fortführen
können. Sie reagieren lediglich in Abbruch-Reaktionen mit
anderen Radikalen.
|