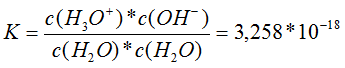|
||||||||||||||||||||||||||
Rechnen mit pH-Werten |
||||||||||||||||||||||||||
|
Beantworte zuerst
folgende Fragen: ________________________________________________________________________________________________________ 2.
Wie können sich in Wasser,
das vielfach in Platingefäßen destilliert wurde, Ionen bilden?
Beweis: derart destilliertes Wasser leitet den elektrischen Strom! ________________________________________________________________________________________________________ 3. Als was fungieren hier Wassermoleküle? Formuliere eine entsprechende
Reaktionsgleichung! ________________________________________________________________________________________________________ 4. Formuliere unter Anwendung des Massenwirkungsgesetzes den
Gleichgewichtsterm dieser Reaktion! ________________________________________________________________________________________________________
5. Wie viel Mole Wasser enthält ein 1 l Wasser? ________________________________________________________________________________________________________ 6. Wie groß ist dann die Massenwirkungskonstante K? ________________________________________________________________________________________________________
7. Wie lautet die exakte mathematische Definition des pH-Werts? Was
bedeutet
`pH"?
8. Begründe mit Hilfe des ________________ des Wassers ______ , warum in
neutralen Lösungen der pH = 7, in sauren Lösungen pH < 7 und in alkalischen
Lösungen pH > ist.
c) im sauren Regen ist c(H3O+) _______ mal größer/kleiner als im natürlichen Regen. 7. Durch Einleiten von Chlorwasserstoffgas (_____________________) in Wasser wird die Oxoniumionen-Konzentration c(H3O+) auf 2,5*10-1 mol/l gebracht. a) Wie groß ist der pH-Wert der Lösung? ________________ b) Wie groß ist die Hydroxidionen-Konzentation? c(OH-) = _______________ |
|
Lösungen: |
||||||||||||||||||||||||||||||||||||||||
|
1. Was bedeuten die Begriffe
`rein", `Reinstoff",
`Reinheitsgrad"? "Reine" Stoffe im absoluten Wortsinn gibt es nicht und kann es nicht geben. Allein schon der Kontakt eines Stoffes mit seiner Umgebung, dem Material des Gefäßes, in dem er z.B. aufbewahrt wird, oder die Reaktion mit Sauerstoff aus der Luft führen zu einer Verunreinigung. "Rein" ist also ein relativer Begriff, den verschiedene Organisationen und Institutionen unterschiedlich definieren. Präparate für biochemische Zwecke sind hochreine Reagenzien für die biochemische Forschung und Analytik sowie für die modernen Methoden der Molekularbiologie und Gentechnologie. Braucht man Chemikalien, um bestimmte Präparate herzustellen, tragen diese die Bezeichnung "zur Synthese". Produkte mit der Bezeichnung "reinst" oder "rein" eignen sich für die technische Industrie und Pharmaproduktion. Sie sind schon relativ unrein. Da bei einer chemischen Synthese nie 100% der/des gewünschten Endprodukte/s entsteht, sondern immer mehrere Endprodukte, macht es keinen Sinn, hochreinste Stoffe für derartige Synthesen zu verwenden. Es liegt dann an den Trenn- und Reinigungsprozessen am Ende der Produktionskette, ein reines, hochreines, höchst gereinigtes Produkt herzustellen. Und das enthält immer noch jede Menge Verunreinigungen, siehe oben. Am "saubersten" sind i.a. Chemikalien für die Analytik. Der Preis eines bestimmten Produkts ist proportional dem Reinheitsgrad. Dazu ein Beispiel:
Jede Kommastelle an mehr Reinheit nach dem Komma ist entsprechend aufwendig und teuer. Ein Stoff mit der Kategorie "Zur Synthese" = 99,0% hat immer noch 1% Unreinheit, also 10 g Fremdstoffe auf 1 kg des deklarierten Stoffes. |
||||||||||||||||||||||||||||||||||||||||
|
2. Wie können sich
in Wasser, das vielfach in Platingefäßen destilliert wurde, Ionen bilden? Beweis:
derart destilliertes Wasser leitet den elektrischen Strom! Die einzige Erklärungsmöglichkeit ist die, dass das Wasser mit sich selbst zu Ionenverbindungen reagiert:
Zahlen aus "Datensammlung Chemie in SI-Einheiten" von G. H. Aylward/ T. J. V. Findlay, Weinheim |
||||||||||||||||||||||||||||||||||||||||
|
3.
Als was fungieren hier Wassermoleküle? Formuliere eine entsprechende
Reaktionsgleichung! Wassermoleküle fungieren also gleichzeitig als Säure- und Basen-Teilchen, sie wirken als Ampholyt. |
||||||||||||||||||||||||||||||||||||||||
|
4. Formuliere unter
Anwendung des Massenwirkungsgesetzes den
Gleichgewichtsterm dieser Reaktion!
K ist eine dimensionslose Zahl! |
||||||||||||||||||||||||||||||||||||||||
|
5.
Wie viel Mole Wasser enthält ein 1 l Wasser?
Wie kommt man zum Ergebnis von K? Es gelten die Beziehungen: c(H2O) = n(H2O) / V und n(H2O) = m(H2O) / M(H2O) Daraus ergibt sich für c(H2O) = m / M * 1 / V = 998 g / 18 g/mol * 1 / 1 L = 55,398 mol/L = 56 mol/L 1 L Wasser hat bei 20 °C die Dichte von 0,998 g/L, also hat ein Liter Wasser die Masse von 998 g, die molare Masse ist 18 g/mol Also gilt: K = c(H3O+) * c(OH¯ ) mol2/L2 / (55,398 mol/L)2 = 3,258 * 10-18 Für das Ionenprodukt
c(H3O+) * c(OH¯
) gilt
entsprechend der elektrischen Leitfähigkeit bei 25 °C der Wert 1,008 mol2/L2 |
||||||||||||||||||||||||||||||||||||||||
|
6. Wie groß ist dann die Massenwirkungskonstante K? Die Massenwirkungskonstante K beträgt: K = 3,258 * 10-18 Da die Konzentration des Wassers c(H2O) sehr sehr viel größer ist als die Konzentration an Protonen c(H3O+) und Hydroxidionen c(OH ¯), deswegen sozusagen als konstanter Wert betrachtet werden kann, wird sie in die MWG-Konstante K miteinbezogen zu einer neuen Konstante Kw: =>K*(55,398 mol/l)2 = Kw = c(H3O+) * c(OH G)mol2/L2 = 3,258 *10-18 *(55,398 mol/L)2=>Kw = 9,9986 *10-15 = 1*10-14 : K ist eine dimensionslose Zahl! Damit folgt: ==> c(H3O+) = Kw / c(OH¯) oder c(OH¯) = Kw / c(H3O+) = 1*10-7 Logarithmisch: -log c(H3O+) = pH,
daraus folgt: pH + pOH = pKw |
||||||||||||||||||||||||||||||||||||||||
|
7. Wie lautet die
exakte mathematische Definition des pH-Werts? Was
bedeutet
`pH"? Definition: Der pH-Wert ist der negative [BRIGGsche] dekadische Logarithmus der Wasserstoffionenkonzentration: -log c(H3O+) = pH Für die Benennung "pH"
gibt es mehrere Interpretationen: |
||||||||||||||||||||||||||||||||||||||||
|
8. Begründe
mit Hilfe des Ionenprodukts des Wassers Kw , warum in
neutralen Lösungen der pH = 7, in sauren Lösungen pH < 7 und in
alkalischen
Lösungen pH > ist.
Aus der Gleichung von
Kw folgt: c(H3O+)
= Kw / c(OH¯)
und damit für |
||||||||||||||||||||||||||||||||||||||||
| Aufgaben: | ||||||||||||||||||||||||||||||||||||||||
|
1. Berechne a) den
pH-Wert und b) die Hydroxid-Ionenkonzentration einer Lösung mit
c(H3O+)=3,2*10-10 mol/l. a) pH = 9,495 b) c(OH¯) = 3,125*10-5 |
||||||||||||||||||||||||||||||||||||||||
|
2. Berechne a) die
Konzentration der Oxoniumionen c(H3O+)
und b) den pH-Wert einer Lösung, für die die Konzentration an Hydroxid-Ionen c(OHG)
= 2*10-10 mol/l beträgt. a) c(H3O+) = 5*10-5 mol/L b) pH = 4,301 |
||||||||||||||||||||||||||||||||||||||||
|
3. In einer Lösung wird ein pH-Wert von 2,5 gemessen.
Berechne die Konzentration der a) Oxonium-Ionen und der
b) Hydroxid-Ionen. a) c(H3O+) = 3,162 * 10-3 mol/L b) c(OH¯) = 3,162 * 10-12 mol/L |
||||||||||||||||||||||||||||||||||||||||
|
4. Berechne
die Anzahl der Oxonium-Ionen N(H3O+) in 1
l Wasser bei 22 °C! N(H3O+) = 6,022 * 10-16 L-1 |
||||||||||||||||||||||||||||||||||||||||
|
5. Wie verändert sich die Oxonium-Ionen-Konzentration
einer Lösung, wenn sich der pH-Wert wie folgt
verändert: (s. Tabelle rechts);
pH-Wert: Verdoppelung
von 4 auf 8: dann wird c(H3O+) 10.000-tausend
mal (10-4 ) mal kleiner (Faktor: 10-4 ) |
||||||||||||||||||||||||||||||||||||||||
|
6. Füll aus, indem du jeweils das
falsche Wort streichst
und den richtigen
Faktor einsetzt: a) in Zitronensaft ist c(H3O+) 10+8 mal größer/ b) in Darmsaft ist c(H3O+) 5*10+7 mal c) im sauren Regen ist c(H3O+) 50 mal größer/ |
||||||||||||||||||||||||||||||||||||||||
|
7. Durch
Einleiten von Chlorwasserstoffgas (Hydrogenchlorid) in Wasser
wird die Oxoniumionen-Konzentration c(H3O+) auf 2,5*10-1 mol/l gebracht.
a) Wie groß ist der pH-Wert der Lösung? pH = 0,6 b) Wie groß ist die Hydroxidionen-Konzentation? c(OH¯) = 3,98 * 10-14 mol/L |
||||||||||||||||||||||||||||||||||||||||
|
update am: 02.02.21 zurück zur Hauptseite |
||||||||||||||||||||||||||||||||||||||||