|
Elektronen fließen in einem metallischen Leiter =Draht nur dann,
wenn eine Potentialdifferenz = Spannung
zwischen den beiden Drahtenden existiert. Ebenso fließt der
Elektronenstrom bei einer Redoxreaktion
vom
Reduktionsmittel (gibt Elektronen ab)
zum Oxidationsmittel (nimmt Elektronen auf) nur,
wenn eine solche Potentialdifferenz zwischen den korrespondierenden
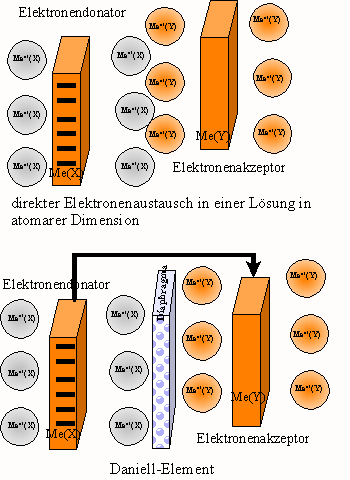
Redoxpaaren besteht. Berühren sich die beiden Redoxsysteme, also die
betreffenden Metalle mit ihren jeweiligen Ionen in Lösung, dann
findet der Elektronenstrom innerhalb
atomarer
Dimensionen statt (z.B. wenn man zwei verschiedene Metalle als
Zahnfüllungen hat: Gold und Quecksilber [Amalgam]). Trennt man die
beiden Redoxreaktionen jedoch
räumlich voneinander und erfolgt der
Elektronenstrom durch einen Draht, spricht man von einem
galvanischen
Element.
Wie kommt die Potentialdifferenz
zustande?
Jedes Metall besitzt das Bestreben, in wässriger Lösung Ionen
zu bilden. Dieses Verhalten wird als
Lösungstension bezeichnet, es ist von Metall zu
Metall unterschiedlich. Qualitativ lässt es sich erklären aus
dem Bestreben nach einen Konzentrationsausgleich: im festen
(metallischem) Medium befinden sich
alle
Metallatome bzw. Metallionen, in wässriger Lösung keine. Es
lösen sich jedoch von den Metallen keine Atome ab, sondern Ionen -
unter Verlust von Elektronen. Die Abgabe von Elektronen ist ein
energetischer Vorgang: das Atom wird ionisiert,
Ionisierungsenergie muss aufgewendet werden.
Gleichzeitig muss das Metallion aus dem Gitter der Metallatome
herausgelöst werden, also muss auch
Sublimationsenergie aufgewendet werden. Geht das
Metall als Ion in Lösung, wird dagegen
Hydratisierungsenergie frei, weil nun der
Ladungszustand des Metallions auf ein größeres Volumen an
hydratisierten Wassermolekülen verteilt wird: die Ladungsdichte
sinkt.
Von der
Differenz aufzuwendender und freiwerdender Energien
hängt es ab, wie groß die Ladungstension eines Metalles
ist.
|
|
|
Die Ladungstension hängt aber auch
davon ab, wie groß die Konzentration der Ionen in der Lösung
schon ist: bei großer Ionenkonzentration in der Lösung ist die
Lösungstension kleiner und umgekehrt.
Im Daniell-Element besitzt das Zink eine große
Lösungstension, das Bestreben der Zinkionen, zu Atomen zu werden,
ist äußerst gering. Im Kupfer dagegen sind die
Verhältnisse umgekehrt: die Cu-Atome besitzen eine ganz geringe
Lösungstension, das Cu-Ion dagegen eine starke Tendenz, wieder zum
Atom zu werden. Das bedeutet: auf der Zinkseite herrscht ein großer
Lösungsdruck, also auch der Druck, Elektronen abzugeben, da ja
ansonsten die Vorgänge in der Helmholtz-Doppelschicht zum Stillstand
kommen, auf der Kupferseite ist es umgekehrt. Elektronen fließen vom
Ort eines hohen Elektronendrucks zu Orten niedrigen Elektronendrucks, die
Elektronendruckdifferenz ist also
letztendlich die elektrische Potentialdifferenz.
Die Lösungstension eines
Metalles als Elektronendonator im Gleichgewicht mit seinen Ionen
führt nun in jeden Fall zur Ausbildung einer
Ladungsdoppelschicht = elektrochemischen
Doppelschicht = Helmholtz-Doppelschicht (siehe Text "Potenzialbildung an
Elektroden"). Ist das Metall allein im Gleichgewicht mit seinen Ionen,
kommt der Lösungsvorgang wegen der Ausbildung dieser Doppelschicht
bald zu Ende. Das bedeutet, ein Metall bildet mit seinen Ionen im
Gleichgewicht ein elektrisches Potential aus, das
Elektrodenpotenzial E.
Nur: dieses Elektrodenpotenzial E ist alleine,
für sich genommen nicht messbar. Eine Messung ist immer ein
Vergleich: die Aussage über z.B. die Länge eines Gegenstandes
ergibt sich aus dem Vergleich mit der Zentimeter-Skala. Diese leitet sich
ab von der Meter-Skala, diese vom Erdumfang usw. usf.
Das Elektrodenpotenzial E ist also als solches
nicht messbar, aber wenigstens definierbar und nennbar. Erst der
Vergleich zweier Elektrodenpotenziale ergibt als Potenzialdifferenz eine
messbare Spannung.
|