|
||||||||||||||||||||||||||||||
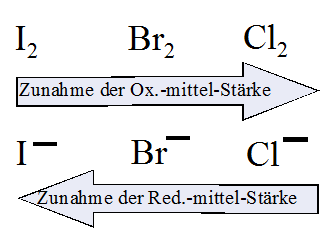
Redoxpotenziale der Nichtmetalle |
||||||||||||||||||||||||||||||
| Stellvertretend für Nichtmetalle und ihre Reaktionen
in wässrigen Lösungen werden die Reaktionen
der Halogene in den folgenden
Versuchen untersucht. |
||||||||||||||||||||||||||||||
V1:
Zu verdünnten wässrigen Lösungen von
Alkalihalogenid-Salzen
werden 5 mL wässrige
Lösungen der Halogene gegeben. Nach der
Reaktion werden 5 mL Heptan gegeben. Die Beobachtungen werden
notiert.
Weitere Beobachtungen: _____________________________________________________________ __________________________________________________________________________________
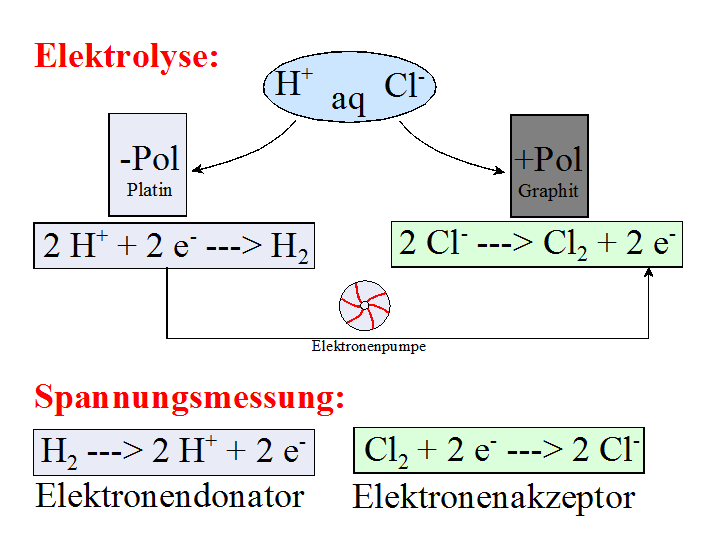
V2:
In einem U-Rohr wird mit einer Platin-Elektrode ( Beobachtung: gemessene Spannung: ____ V, Polung:
V3:
In die Schenkel eines U-Rohrs mit einer Trennfritte werden
einerseits Salzsäure (Pt-Elektrode,
Beobachtung: gemessene Spannung: ____ V, Polung:
Arbeitsaufträge: A1: Formuliere die Reaktionsgleichungen der Reaktionen zwischen Halogenid-Salzen und Halogenen! A2. Formuliere die Reaktionsgleichungen zu V2 und V3! A3. Wer ist bei der Reaktion Halogen-Molekül mit Halogen-Ion Reduktionsmittel und wer ist Oxidationsmittel? A4. Stelle eine Redoxreihe der Halogene auf! A5. Vergleiche deine Aufstellung der Redoxreihe der Halogene mit der Tabelle im Buch. Ordne die Halogen-Moleküle bzw. -Ionen nach steigendem Oxidations- bzw. Reduktionsvermögen. Vergleiche mit der Redoxreihe der Metalle: Wo sind Gemeinsamkeiten, wo sind die Unterschiede? A6. Wo genau und warum arbeitet man bei den Versuchen V2 und V3 mit Kohle-Elektroden?
|
||||||||||||||||||||||||||||||
|
Lösungen: |
||||||||||||||||||||||||||||||
Ergebnisse von
V1:
Weitere Beobachtungen: Die organische Phase (Hexan) sammelt sich oben aufgrund der geringeren Dichte. Versuch c) ist die Umkehrung von Versuch a). |
||||||||||||||||||||||||||||||
|
V2: Beobachtung:
gemessene Spannung:
1,36 V, Polung: |
||||||||||||||||||||||||||||||
|
V3: Beobachtung:
gemessene Spannung:
1,07 V, Polung: |
||||||||||||||||||||||||||||||
| Arbeitsaufträge: A1: Formuliere die Reaktionsgleichungen der Reaktionen zwischen Halogenid-Salzen und Halogenen! a) Cl2(aq) + 2 K+(aq) Br ̶ (aq) ----> Br2(aq) + 2 K+(aq) + 2 Cl ̶ (aq) b) Cl2(aq) + 2 K+(aq) I ̶ (aq) ----> I2(aq) + 2 K+(aq) + 2 Cl ̶ (aq) c) Br2(aq) + 2 K+(aq) Cl ̶ (aq) ----> keine Reaktion! d) Br2(aq) + 2 K+(aq) I ̶ (aq) ----> I2(aq) + 2 K+(aq) + 2 Br ̶ (aq) Vereinfacht: a) Cl2(aq) + 2 Br ̶ (aq) ----> Br2(aq) + 2 Cl ̶ (aq) b) Cl2(aq) + 2 I ̶ (aq) ----> I2(aq) + 2 Cl ̶ (aq) d) Br2(aq) + 2 I ̶ (aq) ----> I2(aq) + 2 Br ̶ (aq) A3. Wer ist bei der Reaktion Halogen-Molekül mit Halogen-Ion Reduktionsmittel und wer ist Oxidationsmittel? In Wasser gelöstes Chlorgas Cl2(aq)
nimmt von gelösten Bromid-Ionen Br
̶ (aq) Elektronen auf, bzw. von Iodid-Ionen
I ̶
(aq). (In Wasser gelöstes) Chlorgas
ist das stärkste Oxidationsmittel. Das Halogenatom (aus dem Molekül) kann nur Elektronen aufnehmen, ist also immer Oxidationsmittel! Das Halogen-Ion kann nur Elektronen abgeben, ist also immer Reduktionsmittel!
A4. Stelle eine Redoxreihe der Halogene auf!
A2.
Formuliere die Reaktionsgleichungen zu V2 und
V3: Die in der Galvanischen Zelle ablaufende Zellreaktion (= Spannungsmessung) ist die Umkehrung der Elektrolyse-Reaktion! A5. Vergleiche deine Aufstellung der Redoxreihe der Halogene mit der Tabelle im Buch. Ordne die Halogen-Moleküle bzw. -Ionen nach steigendem Oxidations- bzw. Reduktionsvermögen. Vergleiche mit der Redoxreihe der Metalle: Wo sind Gemeinsamkeiten, wo sind die Unterschiede? Bei den Metallen sind die Atome die Elektronen-Donatoren = Reduktionsmittel, bei den Nichtmetallen sind es die Ionen. Bei den Metallen sind die Ionen die Elektronen-Akzeptoren = Oxidationsmittel, bei den Nichtmetallen die Atome bzw. Moleküle. Bei beiden gilt: Ist das Metall-Atom bzw. Nichtmetall-Ion ein starker Donator, ist das Metall-Ion bzw. das Nichtmetall-Atom ein schwacher Elektronen-Akzeptor. A6. Wo genau und warum arbeitet man bei den Versuchen V2 und V3 mit Kohle-Elektroden? Kohle-Elektroden ( = Graphit-Elektroden) sind inert, reagieren also nicht mit dem Halogen. Dagegen wird Platin von Chlor und Brom angegriffen.
|
||||||||||||||||||||||||||||||
|
Quelle: Tausch/v. Wachtendonk, Chemie 2000+, Band 2; Bamberg
2004
update: 30.01.21 zurück zur Hauptseite |
||||||||||||||||||||||||||||||