|
Aus der Praxis:
Diese Versuche sind eine gute Möglichkeit, die Theorie mit der
Praxis zu verbinden. Auf diese Weise erkennen Schüler die Hintergründe von
tatsächlichen Phänomenen. Jeder kennt das Problem, dass Autos und Motorräder
häufig Rost ansetzen, wenn sie etwas älter sind. An der Verkleidung ist es
unproblematisch und stört lediglich die Optik. An tragenden Teilen ist das schon
etwas kritischer. Da ist es praktisch, wenn man weiß, wie der Rost entsteht und
wie er sich
verhindern
lässt.
|
Lösungen der Arbeitsaufträge und
Auswertung:
| |
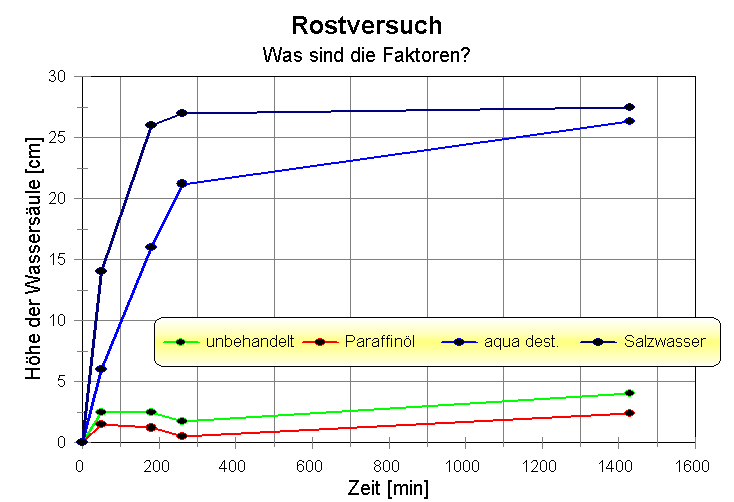
| 1. Beobachtungen zu den Versuchen:
V1: Die mit Paraffinöl
behandelte Eisenwolle ist geschützt und rostet so gut wie gar nicht.
Die "unbehandelte" Eisenwolle rostet ebenfalls nur wenig, aber sie ist
eben nicht unbehandelt, sondern wird vom Hersteller mit einer
Öl-/Fett-Mischung oberflächenbehandelt. Der/die Kunde/in im Baumarkt
wird schließlich keine rostige Eisenwolle kaufen wollen.
Die mit dest. Wasser versetzte Eisenwolle rostet sehr schnell, noch
schneller allerdings die mit Salzwasser behandelte.
|
Minuten nach
Versuchbeginn
|
0 |
50 |
180 |
260 |
1430 |
|
Höhe der
Wassersäule
[cm] in einem längeren Glasrohr |
| a)
unbehandeltes Eisen |
0,0 |
2,5 |
2,5 |
1,7 |
4,0 |
| b) Paraffinöl
getränkt |
0,0 |
1,5 |
1,2 |
0,5 |
2,4 |
| c) aqua dest.
versetzt |
0,0 |
6,0 |
16,0 |
21,2 |
26,3 |
| d) Salzwasser
versetzt |
0,0 |
14,0 |
26,0 |
27,0 |
27,5 |
|
1. Beobachtungen
Versuchsergebnisse:
V1:
Reihenfolge der rostfördernden Faktoren: 1. Salzwasser = Wasser + Salz,
2. Wasser, 3. Sauerstoff (im Wasser gelöst oder aus der Luft)
.
V2:
Beim Erhitzen von Rost im Rggl. sammelt sich
Wasser im kälteren Teil des Rggl. oben, ein Teil des Wassers entweicht
als Wasserdampf. Das gebildete Wasser kann man mit weißem Kupfersulfat
nachweisen (wird türkisgrün) oder mit Watesmo-Papier.
V3:
Beim Erhitzen verändert das gelbe Eisenoxalat
seine Farbe und wird schwarz. Gießt man es in die Auffangschale,
leuchtet es beim Kontakt mit der Luft auf und bildet dann ein rostrotes
Pulver (rotes Eisenoxid).
V4:
Am Eisenblech, das mit Stickstoff umspült wird,
gehen Eisen(II)-Ionen in Lösung. Mit Kaliumhexacyanoferrat(III)-Lösung
entsteht eine blaue Farbe: Berliner Blau. Da die NaCl-Lösung mit rotem
Blutlaugensalz versetzt wurde, ist diese erst mal leicht gelb. Das
Berliner Blau erscheint dann anfangs erstmal dunkelgrün. Die mit
Phenolphthalein versetzte Lösung wird lila-violett.
Die Stromstärke steigt von 0 auf
1,47 mA an. Bei Beendigung der Gaszufuhr sinkt der Stromwert ab und
steigt dann wieder an.
2.
Bedingungen für das Rosten:
siehe "Reihenfolge..." und Sauerstoff als begrenzender
Faktor.
3. Funktion
der Zusätze von Phenolphthalein und Kaliumhexacyanoferrat(III)-Lösung:
Phenolphthalein
ist für den Nachweis von Hydroxid-Ionen: die Lösung färbt sich
lila-violett. Kaliumhexacyanoferrat(III)-Lösung ist für den Nachweis von
Eisen(II)-Ionen: es bildet sich eine blaue Farbe (Berliner Blau).
4. Richtung
des Stromflusses:
Der mit Sauerstoff begaste Pol ist der +-Pol, der
mit N2
begaste der −-Pol. Am −-Pol gehen Eisen(II)-Ionen in Lösung (Nachweis durch
Kaliumhexycyanoferrat(III)), am +-Pol wird Sauerstoff reduziert.
5.
Beobachtungen zu V4 vor und nach der Gasspülung:
Vor der Spülung: Es passiert nichts,
weil keine feststellbare Reaktion zwischen Eisenatomen, Wasser,
Phenolphthalein und den verschiedenen Ionen (Na+-, Clorid¯-,
K+-, Hexacyanoferrat(III)-Ionen auszumachen ist.
Während der Spülung: An
dem mit Sauerstoff umspülten Eisenblech entstehen Hydroxyd-Ionen: O2(g)
+ 2 H2O + 4 e¯ ---> 4 OH¯ :
Reduktionsseite.
Am −-Pol
entstehen durch Oxidation diese 4 Elektronen: 2 Fe ----> 2 Fe2+
+ 4 e¯; Oxidationsseite
Nach der Spülung:
Zwischen der Oxidationsseite (Eisen(s) mit
Fe2+(aq) und der
Reduktionsseite (O2(aq) mit
OH¯-Ionen (aq) und der Eisenplatte als
metallischem Leiter entsteht ein galvanisches Element. Es könnte eine
Spannung gemessen werden. Weil kein gasförmiger Sauerstoff mehr fließt,
werden auch keine Elektronen mehr aufgenommen, die Stromstärke sinkt auf
0. Mit der Ausbildung eines galvanischen Elements ist ein geringer
Stromfluss verbunden, der nach einem bestimmten Maximum wieder auf 0
absinken wird.
Reaktionsgleichungen zur
Rostbildung:
Schritt 1:
Bildung des Eisen(II)-hydroxids:
Oxidation von Eisen Fe(s) --> Fe2+ + 2 e¯
Reduktion
von Sauerstoff [in Anwesenheit von Wasser]: O2(g)
+ 2 H2O (l) + 4 e¯ ----> 4 OH¯(aq)
Redoxreaktion:
2 Fe(s) + 1 O2(g) + 2 H2O (l)
---> 2 Fe(OH)2(s) Eisen(II)-hydroxid
Schritt 2: Weiteroxidation des Eisen(II)-hydroxids:
Oxidation von Eisen(II)-hydroxid: Fe(OH)2(s)
+ 1 OH¯(aq) ---> Fe(OH)3(s) + 1 e¯
Reduktion von Sauerstoff: O2(g) + 2 H2O(l) +
4 e¯ ----> 4 OH¯(aq)
Redoxreaktion:
4 Fe(OH)2(s) + O2(g) +
2 H2O(l) ---> 4 Fe(OH)3(s)
Rostbildung: Fe(OH)3(s) ---> FeO(OH)(s) + H2O(l);
Rost = Eisenoxidhydroxid
Siehe dazu auch
Rost - der
Feind des Eisens
im
pdf-Format und
Rost - der Feind des
Eisens
im
WordPerfect-Format.
| | |