Geräte und
Chemikalien:
1 Spannungsmessgerät, 1 Elektrochemie-Arbeitsplatz,
Elektroden verschiedener Metalle, Lösungen der Salze dieser Metalle mit
der Konzentration c=0,1 mol/l, Verbindungskabel;
Pipetten;
Versuchsdurchführung: |
| 1. |
Reinige die Oberflächen der Metalle
durch Schmirgeln mit einem Schmirgelpapier oder dem
Schmirgelstein. |
| 2. |
Fülle die Kammern des Zellenblocks entsprechend
den Angaben auf der Folie bzw. der unteren Tabelle mit den verschiedenen Salzlösungen.
Die Füllhöhe soll 3/4 der Kammerhöhe
nicht überschreiten. |
| 3. |
Kombiniere die Halbzellen-Elemente Zn/Zn2+,
Fe/Fe2+, Cu/Cu2+,
Ag/Ag+ miteinander zu galvanischen Elementen, wie auf
der Folie „Schema der Versuchsanordnungen"
dargestellt. Trage die Messwerte in die Tabelle ein. |
| 4. |
Reinige abschließend die Oberflächen der Metalle durch
Schmirgeln mit einem Schmirgelpapier und trockne sie
anschließend. Die Kammern der Zellblöcke werden mit normalem
Wasser, danach mit aqua dest. ausgewaschen. Die Salzlösungen
werden getrennt entsorgt. |
|
Tabelle der Messwerte:
(Schema: Metall-1 /Lösung seines Salzes-1 //Metall-2 /Lösung seines Salzes-2)
| 1. |
Zn(s) / ZnSO4(aq) |
Fe(s) / FeSO4(aq) |
+Pol:_______
-Pol:_______ |
ΔE
= ___________ [V] |
| 2. |
Zn(s) / ZnSO4(aq) |
Cu(s) /CuSO4(aq) |
+Pol:_______
-Pol:_______ |
ΔE
= ___________ [V] |
| 3. |
Zn(s) / ZnSO4(aq) |
Ag(s) / AgNO3(aq) |
+Pol:_______
-Pol:_______ |
ΔE
= ___________ [V] |
| 4. |
Fe(s) / FeSO4(aq) |
Cu(s) /CuSO4(aq) |
+Pol:_______
-Pol:_______ |
ΔE
= ___________ [V] |
| 5. |
Fe(s) / FeSO4(aq) |
Ag(s) / AgNO3(aq) |
+Pol:_______
-Pol:_______ |
ΔE
= ___________ [V] |
| 6. |
Cu(s) /CuSO4(aq) |
Ag(s) / AgNO3(aq) |
Pol:_______
-Pol:_______ |
ΔE
= ___________ [V] |
|
Arbeitsaufträge: |
|
| 1. |
Notiere in der Tabelle, welches
Halbelement +Pol und welches
-Pol ist und ermittle die Spannung zwischen diesen
galvanischen Elementen. |
| 2. |
Formuliere die entsprechenden Zellenreaktionen: -Pol
ist immer der Elektronendonator! |
| 3. |
Welches Metall ist immer der negative Pol und
welches immer der positive Pol?
_________________________________________________________________________
|
| 4. |
Stelle die Messwerte
systematisch und
übersichtlich in einem Balkendiagramm
graphisch dar. (Extrablatt, Millimeter-Papier!) |
| 5. |
Welche Beziehungen lassen sich zwischen den
verschiedenen Halbelement-Kombinationen aufstellen?
_________________________________________________________________________
_________________________________________________________________________
_________________________________________________________________________ |
| 6. |
Vergleiche die Spannungswerte der einzelnen
Kombinationen mit der Stellung der Redoxpaare in der Redoxreihe
(Buch Chemie 2000+, Band 2 Oberstufe, S. 23) |
| 7. |
Das Redoxpaar Pb//Pb2+
hat das
Standardelektrodenpotenzial von -0,13 V. Welche Spannungen
ließen sich in Kombinationen mit
Zn(s)/Zn2+, Fe(s)/Fe2+, Cu(s)/Cu2+
und Ag(s)/Ag+ erwarten? |
|
|
Lösungen: |
| |
| Arbeitsaufträge: |
|
1.Notiere in der Tabelle, welches
Halbelement +Pol und welches
-Pol ist und ermittle die Spannung zwischen diesen galvanischen
Elementen.
Tabelle der Messwerte:
(Schema: Metall-1 /Lösung seines Salzes-1 //Metall-2 /Lösung seines Salzes-2)
|
1. |
Zn(s) / ZnSO4(aq) |
Fe(s) / FeSO4(aq) |
+Pol: Fe -Pol:
Zn
|
ΔE
= 0,526 [V] |
|
2. |
Zn(s) / ZnSO4(aq) |
Cu(s) /CuSO4(aq) |
+Pol: Cu -Pol:
Zn
|
ΔE
= 1,080 [V] |
|
3. |
Zn(s) / ZnSO4(aq) |
Ag(s) / AgNO3(aq) |
+Pol: Ag -Pol:
Zn
|
ΔE
= 1,527 [V] |
|
4. |
Fe(s) / FeSO4(aq) |
Cu(s) /CuSO4(aq) |
+Pol: Cu -Pol:
Fe
|
ΔE
= 0,594 [V] |
|
5. |
Fe(s) / FeSO4(aq) |
Ag(s) / AgNO3(aq) |
+Pol: Ag -Pol:
Fe
|
ΔE
= 1,054 [V] |
|
6. |
Cu(s) /CuSO4(aq) |
Ag(s) / AgNO3(aq) |
+Pol: Ag -Pol:
Cu
|
ΔE
= 0,435 [V] |
|
| |
| 2.Formuliere die entsprechenden Zellenreaktionen: -Pol
ist immer der Elektronendonator! |
Entsprechend dem Schema:
Metall 1 + Metallion 2
reagieren
Zn(s) + Fe2+(aq)
Zn(s) + Cu2+(aq)
Zn(s) + 2 Ag+(aq) |
 |
Metallion 1 + Metall 2
Zn2+(aq) + Fe(s)
Zn2+(aq) + Cu(s)
Zn2+(aq) + 2 Ag(s) usw.
|
| 3.Welches Metall ist immer der negative Pol und
welches immer der positive Pol?
Negativer Pol
oder Elektronendonator ist immer
das Metall, das in der Spannungsreihe der Metalle links vom
Reaktionspartner steht oder in der metallischen Form über dem
Reaktionspartner in ionischer Form.
|
4.Stelle die Messwerte systematisch und
übersichtlich in einem Balkendiagramm graphisch dar. (Extrablatt, Millimeter-Papier!)
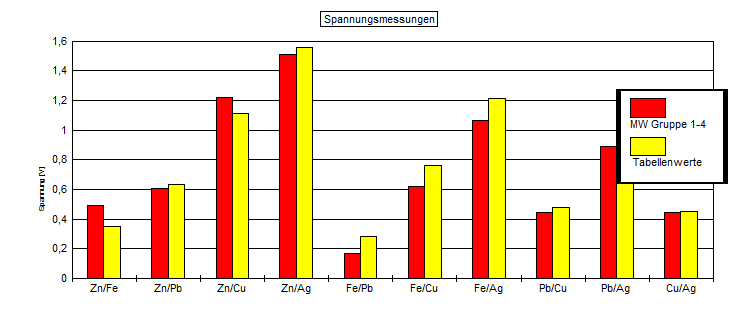 |
| 5.Welche Beziehungen lassen sich zwischen den
verschiedenen Halbelement-Kombinationen aufstellen?
Verschiedene Halbelement-Kombinationen lassen sich
addieren: Die Addition der Kombinationen Zn/Fe (0,32 V) + Fe/Pb (0,31 V)
+ P/Cu (0,47 V) ergibt mit 1,1 V den gleichen Wert wie die Kombination
Zn/Cu. Das gilt auch für andere Kombinationen.
|
| 6.Vergleiche die Spannungswerte der einzelnen
Kombinationen mit der Stellung der Redoxpaare in der Redoxreihe
(Buch Chemie 2000+, Band 2 Oberstufe, S. 23)
Abgesehen von experimentellen Ungenauigkeiten und
Messfehlern ergeben sich die Spannungswerte der einzelnen Kombination
durch Addition der Standardpotentiale nach folgender Formel:
ΔE0 = E0Kathode
- E0Anode = E0Pluspol
- E0Minuspol = + 0,34 V - (-0,76 V) = 1,10 V für
die Kombination Zn/Zn2+ // Cu/Cu2+
ΔE0 = E0Kathode
- E0Anode = E0Pluspol
- E0Minuspol = + 0,80 V - (+0,34 V) = 0,46 V für
die Kombination Cu/Cu2+ // Ag/Ag+
|
| 7. Das Redoxpaar Pb//Pb2+ hat das
Standardelektrodenpotenzial von -0,13 V. Welche Spannungen
ließen sich in Kombinationen mit
Zn(s)/Zn2+, Fe(s)/Fe2+, Cu(s)/Cu2+
und Ag(s)/Ag+ erwarten?
Zn(s)/Zn2+
// Pb//Pb2+ = - 0,13 V - ( - 0,76 V) = 0,63 V
Fe(s)/Fe2+ // Pb//Pb2+
= -0,13 V - (- 0,41 V) = 0,28 V
Pb//Pb2+ // Cu(s)/Cu2+
= +0,35 V - (-0,13 V) = 0,48 V
Pb//Pb2+ // Ag(s)/Ag+
= 0,80 V - (- 0,13 V) = 0,93 V |
| |
update am:
02.02.21
zurück
zur Hauptseite |