|
Versuch: |
Herstellung von festem Chlorhydrat und Bau einer
Zink/Chlor-Batterie |
| Geräte: |
Kleingasentwickler für Chlor nach Hedinger,
Bechergläser, Kleinelektromotor (aus dem EC-Baukasten), Reagenzglas,
Zellenblock (EC-Baukasten), Voltmeter, Zink-Blech, Verbindungskabel,
Krokodilklemmen (EC-Baukasten), halb-konz. Salzsäure,
Chlorkalk-Tabletten, Kochsalz-Lösung, Eis, dest. Wasser, Kochsalz; |
| Versuchaufbau: |
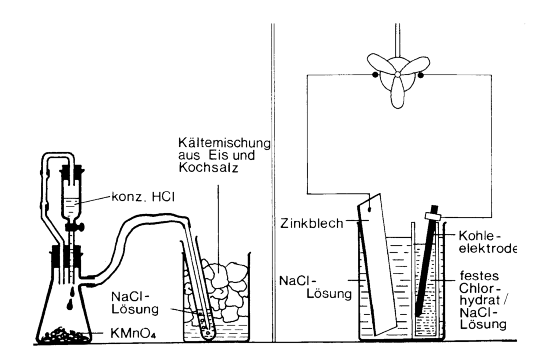
siehe Abbildung [Statt KMnO4: Chlorkalk; statt
Tonzelle: Zellenblock mit Papier] |
| |
|
|
Durchführung:
In einem 100 mL-Becherglas stellt man aus zerstoßenem Eis
und Kochsalz eine Kältemischung her. In diese Kältemischung stellt man ein Rggl, das
etwas dest. Wasser enthält und leitet mit dem
Kleingasentwickler Chlor ein (die Einleitung von Chlor wird
zentral unter dem Abzug vorgenommen). Nach einiger Zeit haben
sich in dem gekühlten Wasser des Rggl. hellgelbe Kristalle
gebildet: Chlorhydrat, Cl2(H2O)6
, das leicht zu handhaben ist und bei +10 °C in Chlor und
Wasser zerfällt. Anhand der Skizze wird eine geeignete
elektrochemische Anordnung mit dem EC-Baukasten aufgebaut und es
werden verschiedene Untersuchungen durchgeführt. Statt der Tonzelle im Becherglas wird der
Zellenblock des EC-Baukastens verwendet: beide Zellen werden mit
Kochsalzlösung gefüllt, in die Halbzelle mit der Kohleelektrode kommt
danach das feste Chlorhydrat. |
 |
|
| |
|
Beobachtungen und Aufgaben: |
|
1. |
Masse des Zn-Blechs vor dem
Versuch: m(Zn,vor) = __________ g, m(Zn,nach)
= __________ g |
|
2. |
Lässt sich vor dem Einfüllen des
Chlorhydrats, nur mit Zink- und Kohleelektrode, eine Spannung
messen? ______? Läuft der angeschlossene Elektrokleinmotor
__________? |
|
3. |
Welche Spannung lässt sich an der
Zelle messen nach dem Einfügen des Chlorhydrats? U = ____ V |
|
4. |
Welche Vorgänge
laufen an den Elektroden ab?
_____________________________________________________________________ |
|
5. |
Welche
Elektrode ist Anode, welche Kathode?
______________________________________________________________________ |
|
6. |
Welche Elektrode ist
+Pol,
welche ist -Pol?
_________________________________________________________________________ |
|
7. |
Berechne die freiwerdende
elektrische Energie bei einem Umsatz von 1 mol Zink nach der
Formel: W = U*I*t = U*z*F mit: U = gemessene Spannung [V],
I=Stromstärke [A], t=Zeit [h], z=Anzahl gewechselter Elektronen
[pro mol], F= Faraday-Konstante 96.478 As; |
|
8. |
Berechne die freiwerdende Energie,
die dem Massenverlust des Zinks entspricht. |
|
Quelle: H. J. Schmidt: Medienmappe zu Elektrochemie; 2. Aufl.,
Köln 1984
update am:
02.02.21 zurück
zur Hauptseite
|