Depolarisationsmischung:
Braunstein: 57%
Graphit: 21%
Ammoniumchlorid: 9%
Zinkchlorid: 1%
Wasser: 12% |
|
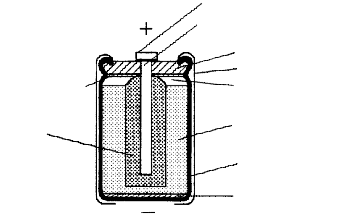 |
Elektrolytzusammensetzung:
Ammoniumchlorid: 26%
(Leitelektrolyt)
Zinkchlorid: 8,8%
(Gelieren des Quellmittels)
Wasser: 62,5%
Sublimat, HgCl2, < 0,1%
(Amalgambildung mit Zn)
Quellmittel: 20-25%
Weizenmehl, Maisstärke, Methylcellulose; |
|
| |
|
|
I.
Primärreaktionen
1. Zn(s) —> Zn2+(aq) + 2 e− Oxidation am
ë-Pol
2. MnO2(s) + 2 e− + 2 H2O(l) —>
2 MnO(OH) + 2 OH−(aq) Reduktion am
Å-Pol
2 OH−(aq) + 2 NH4+ —> 2 NH3(g)
+ 2 H2O(l)
└►pH-Wert steigt
│
==> Potential von MnO(OH)/MnO2 sinkt!
► Isolation der
Kohle-Elektrode ==> Widerstand steigt ==> Stromstärke nimmt
ab!
Betriebspause: Diffusion von NH3(g),
Sekundärreaktion mit Zn2+(aq);
|
|
| |
|
|
II. Sekundärreaktionen
1. Zn2+(aq) + 2 NH3(g) —>
[Zn(NH3)2]2+ (aq) + 2 Cl−
—> [Zn(NH3)2]Cl2
└ aus der
Depolarisationsmischung
Alterungsprozess:
2. Zn2+(aq) + 2 OH−(aq) —>
Zn(OH)2 (s) —> ZnO + H2O (l) |
|
| |
|
|
| Anodenreaktion |
Zn(s) —> Zn2+(aq) + 2 e– |
| Kathodenreaktion |
MnO2(s) + 2 e− + 2 H2O(l) —> 2
MnO(OH) + 2 OH–(aq)
2
OH–(aq) + 2 NH4Cl
—> 2 NH3(g) + 2 H2O(/l) + 2 Cl–(aq) |
| Gesamtreaktion |
Zn(s) + MnO2(s) + 2 NH4Cl —> 2
MnO(OH) + [Zn(NH3)2]Cl2
|