|
Die Elektroden in
der Elektrochemie setzen sich aus einer
metallischen
Phase
und
einer
Lösungsphase
zusammen.
An einer Kupferelektrode
ist der Kupferstab die metallische Phase. Das
Metallgitter des Kupfers enthält Kupfer-Ionen und die
dazugehörigen freibeweglichen Elektronen. Die Lösungsphase einer Kupferelektrode besteht aus einer Kupfer(II)-
Salzlösung, die hydratisierte Kupfer(II)-lonen enthält. In einer
Kupferelektrode befinden sich also Kupfer(II)-lonen sowohl in der
metallischen Phase als auch in der Lösungsphase. Diese Elektrode wird
als
Kupfer/Kupfer-Ionen-Elektrode
bezeichnet und durch folgende Symbole dargestellt:
Cu/Cu2+
.
|
Der Schrägstrich bedeutet die
Phasengrenze.
Elektroden dieser Art werden als Metall/Metall-Ionen-Elektroden
bezeichnet. Eine Metall/Metall-Ionen-Elektrode besteht aus einem
Metall und einer Elektrolytlösung. Beide Phasen enthalten die gleichen
Metall-Ionen.
Zwischen dem Metall und der
Elektrolytlösung liegt die Phasengrenze,
an der sich die Eigenschaften sprunghaft ändern. In einer Metall/Metall-lonen-Elektrode sind die enthaltenen Metall-Ionen in beiden
Phasen
unterschiedlich fest gebunden,
so dass es an der Phasengrenzfläche zu einem Übergang dieser Ionen
kommt. Mit dem Übergang von Metall-Ionen ist ein
Ladungsübergang verbunden.
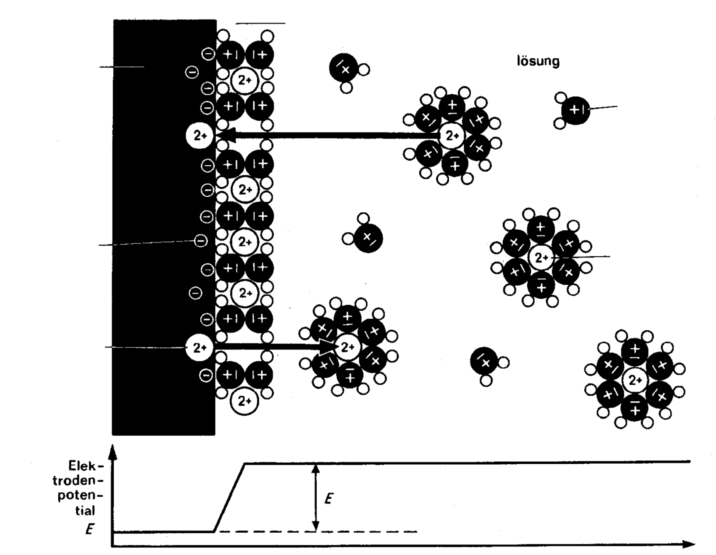
Gehen Metall-Ionen aus der metallischen Phase unter Zurücklassen der
zugehörigen Elektronen in die Lösungsphase über, so wird dadurch die
metallische Phase gegenüber der Lösungsphase negativ aufgeladen. Der
einseitige Übergang von Ladungsträgern vom Metall in die Lösung
führt zwangsläufig zu einem Überschuss an Elektronen in der einen
Phase und zu einem Überschuss an Kationen in der anderen Phase.
An
der Phasengrenze findet damit ein Vorgang der Ladungstrennung statt.
Beide Phasen werden durch den Übergang von Ladungsträgern
entgegengesetzt aufgeladen.
|
 |
|
Wegen der
elektrischen Anziehung
der Ladungsträger
verteilen
sich die Ladungen nicht gleichmäßig auf das Volumen der Phasen,
sondern verbleiben in der Nähe der Phasengrenze. Sie bilden dort
eine Ladungsdoppelschicht.
Durch die elektrische Anziehung entgegengesetzt geladener Teilchen kommt
außerdem der einseitige Übergang von Ladungsträgern zum Stillstand,
an der Phasengrenze stellt sich ein Gleichgewicht
ein. Dieses
Gleichgewicht ist dadurch ge kennzeichnet, dass in gleichen Zeiträumen
im Mittel gleich viel Metall- Ionen in beiden Richtungen durch die
Phasengrenze hin durchtreten. Bei
einer Metall/Metall-lonen-Elektrode wird der Übergang von Metall-Ionen
aus der metallischen Phase in die Lösungsphase einschließlich der dort
stattfindenden Hydratisierung als
Elektrodenreaktion
bezeichnet.
Das gilt auch für die Abspaltung von Wassermolekülen von den
hydratisierten Metall-Ionen und für den Übergang der Metall-Ionen aus
der Lösungsphase in die metallische Phase. Für die Kupfer/Kupfer-Ionen-Elektrode
|
|
Phasenübergang
Cu2+
 Cu2+ Cu2+ |
Der
einseitige Übergang von Metall-Ionen an der Phasengrenze bis
zur Einstellung des Gleichgewichts führt zur Ausbildung eines
elektrischen
Potentials
zwischen
metallischer Phase und Lösungsphase. |
|
|
Dieses
Potential zwischen beiden Phasen wird als
Elektrodenpotential
E
bezeichnet.
Das Elektrodenpotential ist ein
Ausdruck
für die Lage des Gleichgewichts an der Phasengrenzfläche.
Das Elektrodenpotential hängt bei Metall/-Metall-Ionen-Elektroden von
der Art des Metalls,
von der
Konzentration der
Metall-Ionen
in
der Elektrolytlösung und von der
Temperatur
ab. Die
negativ aufgeladenen Ladungsträger in der metallischen Phase auf der
einen Seite und die hydratisierten Metall-Ionen auf der anderen Seite
der Phasengrenze bilden zusammen die
elektrochemische
Doppelschicht. |
|
|
Quelle:
Chemie, Lehrbuch für
Klasse 12, Volk und Wissen VEB Berlin 1975
|