|
Bei aromatischen Carbonsäuren wird die
Acidität
nicht nur durch den
induktiven Effekt
des aromatischen Rings, sondern auch
durch
mesomere
Effekte beeinflusst. Die verglichen
mit
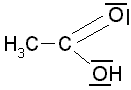
Essigsäure
(pKs: 4,75) etwas höhere Säurestärke von
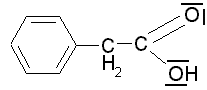
Phenylessigsäure
(pKs: 4,31) ist auf den
-I-Effekt des
Benzolkerns zurückzuführen. Obwohl in
der Benzoesäure der aromatische Ring direkt an die Carboxylgruppe
gebunden ist, der
-I-Effekt
also viel stärker sein müsste, ist Benzoesäue
nur ganz wenig stärker als Phenylessigsäure (C6H5CH2COOH).
Der Grund dafür liegt darin, dass durch den
-I-Effekt
des Benzolkerns das Phenylacetat-Ion
etwas stabilisiert wird, dass aber im Fall der
|
|
 |
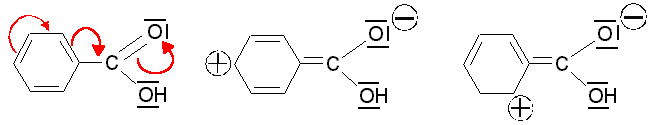 Benzoesäure
das
Säuremolekül selbst stabilisiert wird
und zwar durch den
schwachen
+M-Effekt des Benzolkerns: Benzoesäure
das
Säuremolekül selbst stabilisiert wird
und zwar durch den
schwachen
+M-Effekt des Benzolkerns:
|
| |
Das Anion
hingegen wird durch den +M-Effekt des Rings
destabilisiert, weil die negative Ladung an der Carboxylgruppe erhöht
wird. |
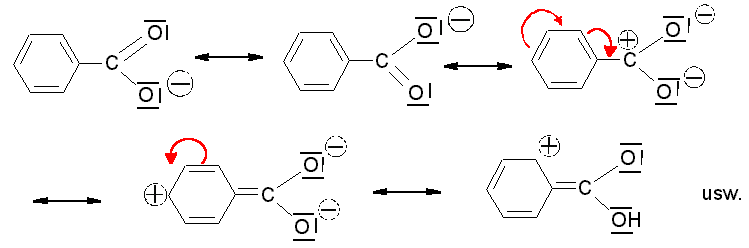
Aciditätsvergleich der Hydroxybenzoesäuren:
|
|
OH-Gruppe in p-Stellung:
übt einen
+I-
und
+M-Effekt
aus, dadurch wird die Acidität verringert. Bei Substituenten mit
mesomerem Effekt tritt
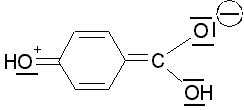 eine
gewisse Konjugation des Substituenten mit den
p-Elektronen des Rings und der
Carboxyl- bzw. Carboxylat-Gruppe ein.
+M-Substituenten
bewirken eine Stabilisierung der Säure und damit eine Destabilisierung
der konjugierten Base durch Erhöhung der negativen Ladungsdichte an der
Carboxylatgruppe. eine
gewisse Konjugation des Substituenten mit den
p-Elektronen des Rings und der
Carboxyl- bzw. Carboxylat-Gruppe ein.
+M-Substituenten
bewirken eine Stabilisierung der Säure und damit eine Destabilisierung
der konjugierten Base durch Erhöhung der negativen Ladungsdichte an der
Carboxylatgruppe. |
Für
m-substituierte
Benzoesäuren
lassen sich keine Grenzformeln in dieser Art zeichnen.
Sie wirken ausschließlich durch ihre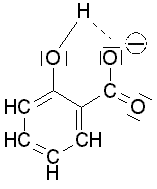 n
induktiven
Effekt.Bei der
o-substituierten Benzoesäure
= Salicylsäure wird das Anion durch Delokalisation seiner negativen
Ladung über
intramolekulare H-Brücken
in einem erheblichen Ausmaß stabilisiert . n
induktiven
Effekt.Bei der
o-substituierten Benzoesäure
= Salicylsäure wird das Anion durch Delokalisation seiner negativen
Ladung über
intramolekulare H-Brücken
in einem erheblichen Ausmaß stabilisiert .
|
|
Literatur:
H.R. Christen, "Grundlagen der organischen Chemie", Aarau 1972 |