|
Ist
die Bildung stabiler Edelgaskonfigurationen durch Abgabe und
Aufnahme von Elektronen die Ursache für die Elektronenübertragung
zwischen Metall und Nichtmetall? Betrachtet man die energetischen
Aspekte dieses Prozesses, dann steht für die Reaktion von 2 Na(s) +
Cl2(g) —> 2 NaCl(s) dem aufzuwendenden Energiebetrag von
+1004 kJ/mol für die Ionisierung
der Na-Atome ein freiwerdender Energiebetrag von -726 kJ/mol für die
Ionisierung der Cl-Atome (Elektronenaffinität) gegenüber. Also
dürfte diese Reaktion eigentlich gar nicht ablaufen!
Tatsache jedoch ist: Geschmolzenes Natrium reagiert ______________
mit Chlorgas unter Abgabe von ____________ (intensiv gelb) und ________,
also in
einer stark ________________ Reaktion. Für 2 Mole gebildeten
Natriumchlorids entsprechend der Reaktionsgleichung wird dabei eine
Reaktionswärme
von - 844 kJ freigesetzt (sog.
____________________ ΔHR
).
Die Ionenverbindung
NaCl ist also _______________________als die Elemente! Die
Bildung von Ionen aus Atomen scheint also ein energetisch
bevorzugter Vorgang zu sein. Um die Bildung der Ionenverbindung zu
klären, müssen also alle Einzelschritte betrachtet werden. Dies
sind im folgenden:
|
Einzelschritte für 2 Na(s) + Cl2(g)
---> 2 NaCl(s) |
Symbol |
Enthalpiebetrag [kJ] |
|
1. Na-Atome verdampfen aus dem festen
Natrium: Sublimation;
Sublimationsenthalpie |
ΔHS |
+ 218 |
|
2. Gasförmige Chlormoleküle müssen in
Chloratome gespalten werden: Dissoziation;
Dissoziationsenthalpie |
ΔHD |
+ 242 |
|
3. Natrium-Atome geben Elektronen ab:
Ionisierungsenergie |
ΔHI |
+ 1004 |
|
4. Chlor-Atome nehmen Elektronen auf:
Elektronenaffinität |
ΔHE |
- 726 |
|
5. Gasförmige Na+
- und Cl--Ionen
bilden ein festes kristallines Gitter:
Gitterenergie |
ΔHG |
? = ______ |
|
Alle Enthalpiebeträge in [kJ/mol]
Die Reaktionswärme
(Reaktionsenthalpie) der Reaktion 2 Na(s) + Cl2(g) –> 2 NaCl(s) beträgt
ΔHR=
- 822 kJ/mol.
Rechnet man alle freiwerdenden und aufzuwendenden Energiebeträge gegeneinander auf:
ΔHS
+ ΔHD +
ΔHI
+
ΔHE + ΔHG = ΔHR
<==>
ΔH
G
= - ΔHS
- ΔHD
- ΔHI
- ΔHE
+
ΔHR
= ___________
so wird deutlich, dass allein die
freiwerdende
_____________________
dafür sorgt, dass der Gesamtprozess
als exotherme Reaktion abläuft. Die
Gitterenergie beträgt dann: _____ kJ/mol gebildeten NaCl. 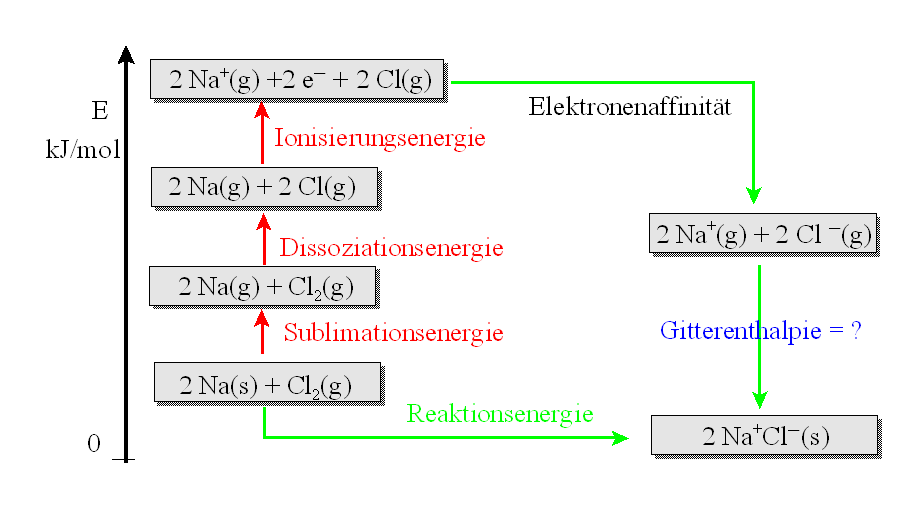
Schlussfolgerung:
Das Erreichen der
Edelgaskonfiguration der beteiligten Ionen ist also nicht die Triebkraft
der Reaktion, sondern die Bildung energiearmer und damit stabiler
Ionenkristalle im festen Zustand.
Der Prozess wird als
Born-Haber-Kreisprozess
dargestellt.
Für die starke
Wärme- und Lichtentwicklung der NaCl-Synthese ist also die Energie, die
freigesetzt wird, wenn sich aus Ionen im Gaszustand ein Gitter im festen
Zustand bildet - die Gitterenergie - verantwortlich. Die Gitterenergie
ist bei vielen Ionenverbindungen im Betrag viel größer als die Summe der
Energien bei der Bildung der Ionen.
Wortliste:
energieärmer,
exotherm, Gitterenergie, heftig,
Wärme, Atome, Licht, Reaktionsenthalpie
Siehe dazu auch
Der
Born-Haber-Kreisprozess als pdf-Datei
und
Der
Born-Haber-Kreisprozess als
WordPerfect-Datei.
update am
10.03.2021
zurück
zur Hauptseite
|
|
