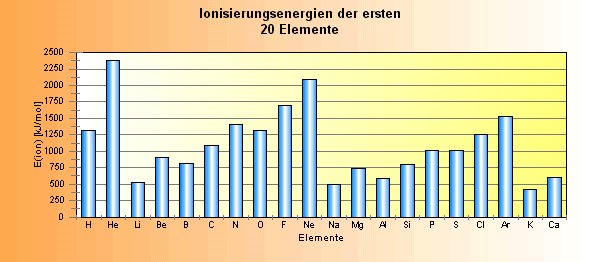
1. Welche Elemente in der jeweiligen Periode haben die höchsten Ionisierungsenergien
(IE) und in welche
Hauptgruppe gehören sie?
Antwort:
Helium (in
der 1. Periode), Neon (in der 2. Periode) und Argon (in der 3. Periode)
haben die jeweils höchste Ionisierungenergie. Sie gehören aller der
VIII. Hauptgruppe der Edelgase an.
2. Welche Elemente in der jeweiligen Periode haben die niedrigsten Ionisierungsenergien und in welche
Hauptgruppe gehören sie?
Antwort:
Lithium (in der 2.
Periode), Natrium (in der 3. Periode) und Kalium (in der 4. Periode) haben die
jeweils niedrigste Ionisierungenergie. Sie gehören aller der I. Hauptgruppe der
Alkalimetalle an.
3. Gibt es irgendeine Art von Regelmäßigkeit im Wachstum der Balken, die
sich wiederholt? Und wenn ja: wo und wie?
Antwort:
Vom 1. zum 2. Element der 2. Periode steigt die IE, fällt dann vom 2. zum 3.
Element und steigt vom 3. über das 4. zum 5. Element an, um dann zum 6. Element
abzufallen. Dieses Muster wiederholt sich in der 3. Periode.
4. Gibt es einen (proportionalen) Zusammenhang zwischen Ionisierungsenergie
und Kernladungszahl des betreffenden Elements? Und wenn ja, dann wo und wie?
Antwort:
Den Zusammenhang zwischen IE und Kernladungszahl gibt es in der 1. Periode, in
der 2. ebenfalls mit der Besonderheit, dass zwischen dem 2. und 3. Element die
EI abfällt und zwischen dem 5. und 6. Element. Dafür muss es einen besonderen
Grund geben.
5. Welcher Art von Kraft ist die Ionisierungsenergie proportional und welche
Art der Energie drückt sie damit eigentlich wie aus?
Antwort:
Die IE ist
umgekehrt proportional zur Lageenergie (potentielle Energie). Sie drückt damit
die Lage des Elektrons zum Kern, also seinen Abstand aus. Natürlich hängt die IE
auch von der Kernladung ab, was sich in dem annähernd proportionalen Verlauf der
IE innerhalb der einzelnen Perioden ausdrückt.
siehe auch:
https://de.wikipedia.org/wiki/Ionisierungsenergie
update am 02.02.2021
zurück
zur Hauptseite