|
Folgende Versuche
werden durchgeführt: |
||||||
|
||||||
|
||||||
| 3. Du kannst die zwischenmolekularen Bindungskräfte des
Wassers erklären! 4. Du weißt, wie Tenside/Seifen die Oberflächenspannung des Wassers vermindern! |
Gruppenpuzzle zum Thema Wasser
|
Expertengruppen und Themen: |
|
Expertengruppen und Themen: Das Kernthema der ersten vier Themen ist die Wasserstoffbrückenbindung. Organisation der Expertengruppen und Expertenrunden: |
|
Schülerzahl |
Expertengruppen |
Expertenrunden |
Kopienanzahl |
|
16 |
AAAA |
ABCD |
4*A |
|
20 |
1) wie bei 16 Schülern, zusätzlich 4*A oder 4*B oder 4*C oder 4*D 2) die 4 leistungsstärksten Schüler bilden gleich eine Expertenrunde und beraten in der 2. Phase die Expertenrunden |
ABCD+A |
1) wie bei 16 Schülern, zusätzlich 2) 1*(A+B+C+D) |
|
24 |
1) wie bei 16 Schülern, zusätzlich (4*A + 4*B) oder (4*A + 4*C) oder (4*A + 4*D) oder (4*B + 4*C) oder (4*B + 4*D) oder (4*C + 4*D) |
ABCD + AB+CD aus der |
1) wie bei 16 Schülern, |
|
28 |
1) wie bei 16 Schülern, zusätzlich (4*A + 4*B + 4*C) oder (4*A + 4*C + 4*D) oder (4*B + 4*C + 4*D) |
ABCD + ABC+ D aus der |
1) wie bei 16 Schülern, |
|
32 |
wie bei 16 Schülern, nur alles doppelt! |
|
Organisation und Durchführung: Phase I: Jeweils zwei/drei/vier Schüler bilden eine Expertengruppen. 4 Schüler sind das Gruppenmaximum. Die Lernziele werden in den Gruppen schriftlich erarbeitet. Phase II: Nach Abschluss der Gruppenarbeit trifft sich die Expertenrunde: Aus jeder Gruppe A, B, C und D nimmt ein Vertreter an der Expertenrunde teil. Bei mehr als 16 Schülern gibt es dann eben mehrere Expertenrunden, bei unvollständigen Expertenrunden mit Unterstützung aus anderen Runden! |
|
Das Wasser |
Bearbeitet von: |
Datum |
|
|
Expertengruppe A |
|
|
|
|
Expertengruppe B |
Siedetemperatur |
|
|
|
Expertengruppe C |
Dichteanomalie |
|
|
|
Expertengruppe D |
Schneekristalle |
|
|
|
Folgende Versuche
werden durchgeführt: |
||||||
|
||||||
|
||||||
| 3. Du kannst die zwischenmolekularen Bindungskräfte des
Wassers erklären! 4. Du weißt, wie Tenside/Seifen die Oberflächenspannung des Wassers vermindern! |
|
Das Wasser |
Bearbeitet von: |
Datum |
|
|
Expertengruppe A |
Oberflächenspannung |
|
|
|
Expertengruppe B |
|
|
|
|
Expertengruppe C |
Dichteanomalie |
|
|
|
Expertengruppe D |
Schneekristalle |
|
|
|
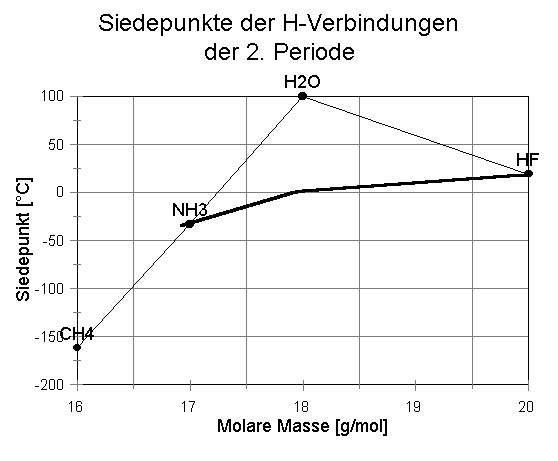
Wir kochen unsere Lebensmittel in Wasser. Es siedet bei 100 °C und wir finden nichts Besonderes daran. Erst ein Vergleich mit den Siedetemperaturen der Wasserstoffverbindungen von Elementen der gleichen Gruppe und der gleichen Periode, in der Sauerstoff im PSE steht, verdeutlicht: Wasser tanzt mit seiner hohen Siedetemperatur aus der Reihe. Verglichen mit den drei anderen Wasserstoffverbindungen seiner Gruppe müsste Wasser aufgrund seiner molekularen Masse bei ca. -80 °C sieden (siehe rechte Abb.). Würde sich Wasser in die Reihe der Wasserstoffverbindungen seiner Nachbarn in der 2. Periode einordnen, so müsste es in der Nähe von 0 °C sieden (vgl. mittlere Abb.). Die hohe Siedetemperatur des Wassers verweist auf relativ starke zwischenmolekulare Anziehungskräfte hin. |
|
|
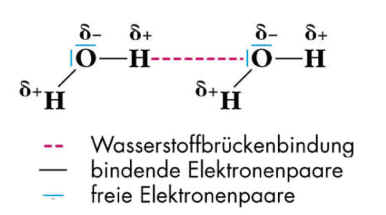
Es handelt sich bei diesen Kräften um Anziehungskräfte zwischen den Molekülen: zwischenmolekulare Anziehungskräfte. Die beiden Bindungen im Wassermolekül sind stark polar (große EN-Differenz => Teilladungen mit δ+ beim H-Atom und δ- beim O-Atom), Polarität und gewinkelte Struktur machen das Wassermolekül zum Dipol. Zwischen den Dipolen gibt es aufgrund der Teilladungen eine elektrostatische Anziehung, die Dipol-Dipol-Kraft. Zusätzlich existiert eine Bindung zwischen einem freien, nicht-bindenden Elektronenpaar eines O-Atoms im Wassermolekül und einem partiell positiv geladenen H-Atom eines benachbarten Wassermoleküls, die Wasserstoffbrückenbindung. Das freie, nicht bindende Elektronenpaar bildet quasi eine "Brücke" zum nächsten Wassermolekül. Diese, durch ein freies, nicht bindendes Elektronenpaar gebildete Wasserstoffbrücke ist fünfmal stärker als die Anziehung aufgrund der Dipol-Eigenschaft. Lernziele zum
Thema Siedetemperatur: |
 |
|
2. Du kannst das Diagramm zum Vergleich der "Siedepunkte von H-Verbindungen aus der 2. Periode" interpretieren. |
 |
|
Das Wasser |
Bearbeitet von: |
Datum |
|
|
Expertengruppe A |
Oberflächenspannung |
|
|
|
Expertengruppe B |
Die hohe Siedetemperatur des Wassers |
|
|
|
Expertengruppe C |
|
|
|
|
Expertengruppe D |
Schneekristalle |
|
|
|
||||
|
||||
|
|
Das Wasser |
Bearbeitet von: |
Datum |
|
|
Expertengruppe A |
Oberflächenspannung |
|
|
|
Expertengruppe B |
Siedetemperatur |
|
|
|
Expertengruppe C |
Dichteanomalie |
|
|
|
Expertengruppe D |
|
|
|
|
||
|
||
|
|
Das Wasser |
Bearbeitet von: |
Datum |
|
|
Expertengruppe A |
Die Oberflächenspannung des Wassers |
||
|
Expertengruppe B |
Siedetemperatur |
||
|
Expertengruppe C |
Zusatztext: Die Dichteanomalie des Wassers: Überleben unter Eis |
||
|
Expertengruppe D |
Schneekristalle |
||
|

Das Überleben von Wassertieren im zugefrorenen Teich hat die Dichteanomalie des Wassers zur Voraussetzung. Zunächst einmal hat die geringe Dichte von Eis zur Folge, dass Teiche nie von unten her, sondern von oben her zufrieren. Das Eis garantiert an seiner Grenze zum Wasser die Gleichgewichtstemperatur von 0 °C, egal wie kalt es "draußen" ist. Hinzu kommt, dass Eis ein hervorragendes Isoliermaterial ist. Die Eisdecke isoliert das Wasser mit zunehmender Dicke immer besser gegen weiteren Wärmeverlust. Es bilden sich unter unseren irdischen Bedingungen deshalb höchstens etwa 75 cm dicke Schichten. Diese schirmen nicht nur die Kälte ab, sondern sind außerdem für die Photosynthese durch Algen ausreichend lichtdurchlässig, so dass auch unter diesen Bedingungen Sauerstoff produziert werden kann.
Unter der Eis/Wasser-Grenze steigt die Temperatur mit der Tiefe des Sees an, um bei etwa 1,20 m stehen zu bleiben. Jetzt ist der Eigendruck auf das Wasser so groß, dass es sein Minimalvolumen erreicht. Damit verbunden ist die Temperatur von 4 °C. Egal wie hoch der Druck wird: Das Wasser hat seine dichteste Struktur erreicht und die damit verbundene Temperatur kann nicht 4 °C unterschreiten, aber auch nicht überschreiten. Dann müßte ja das Volumen des Wassers zunehmen. Deshalb sind ausreichend tiefe Oberflächengewässer, Meere und Ozeane ohne sonderliche Strömungen in größeren Tiefen immer 4 °C kalt - oder 4 °C warm, wenn man so will. Bei diesen Temperaturen fühlen sich Fische und andere Lebewesen recht wohl.
Die Konsequenz aus der Anomalie des Wassers: Tiefere Seen und Meere frieren nach unten hin nie ganz zu. Es gibt genug Raum für das Leben, wenn auch manchmal nur für Leben im Schneckentempo. Wasser garantiert also ideale Bedingungen für das Leben im Wasser - nicht nur in den Ozeanen der Polarregion, sondern auch im Goldfischteich. Allerdings hat die Dichteanomalie auch
negative Auswirkungen auf das Leben im Teich: Die Schichtung des Wassers kann
bei stehenden Gewässern dazu führen, dass ein kontinuierlicher Stoffaustausch
zwischen den Zonen unterbleibt. Daher neigen stehende Gewässer zum
"Umkippen", d. h. zur Ausbildung sauerstoffarmer und deshalb
lebensfeindlicher Zonen. Das ist vor allem bei Seen mit viel Pflanzenwachstum
der Fall. Paradoxerweise versorgen die Wasserpflanzen den See nicht mit
Sauerstoff, wie sie es für die Atmosphäre tun. Denn aufgrund des schnellen
Wachstums (z. B. wegen Düngereintrag) sterben sie auch rascher ab. Beim
Verwesen der Biomasse wird durch die Bakterien übermäßig viel Sauerstoff
verbraucht. Es bilden sich reduzierende Verhältnisse aus. Dadurch entstehen
Methan, Schwefelwasserstoff und Phosphin (PH3). Letzteres entzündet
sich spontan beim Kontakt mit Luftsauerstoff. Hierauf beruhen die Legenden von
den Flämmchen und Geistern im Moor. update am: 02.02.21 zurück zur Hauptseite Quellen: Zur Dichteanomalie des Wassers: http://www.wissenschaft-technik-ethik.de/wasser_dichte.html mit Zahlen der PTB in Braunschweig. |