|
|||||||||||||||||||||||||||||||
Chemische Reaktionen und Energie |
|||||||||||||||||||||||||||||||
|
Folgende Versuche werden (arbeitsteilig)
durchgeführt (V1, V2): Anfangsfarbe: ________________ Endfarbe: _____________________ Anfangstemperatur: _________ °C Endtemperatur: _________________ °C Versuch 2:
Schutzbrille!
Wiederhole Versuch1 mit einer Spatelspitze
Branntkalk* (Calciumoxid*) statt mit weißem Kupfersulfat Anfangstemperatur: _______°C Endtemperatur: ____________________°C |
 |
||||||||||||||||||||||||||||||
|
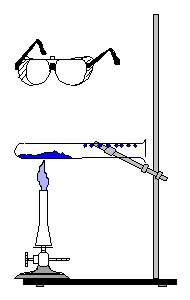
Versuch 3: Schutzbrille! Erhitze in einem waagrecht eingespannten Rggl. eine Spatelspitze blaues Kupfersulfat*. Beobachte die Farbe des Feststoffes und die Wand des Rggl. im nicht erhitzten Teil. Beobachtung: ____________________________________________________ _________________________________________________________________ Versuch 4: Schutzbrille!
Wiederhole V3 mit
Löschkalk* (Calciumhydroxid*). ________________________________________________________________
LV1: Tauche ein
Stück weißen Karton in die bereitgestellte Lösung Nr. 1, lasse
gut abtropfen und bedecke den Karton mit Alu-Folie, in die ein Muster
hineingeschnitten wurde. Belichte ca. 5 min lang auf dem
Tageslichtprojektor und tauche den Karton mit einer Pinzette in eine
Petrischale mit verdünnte Salzsäure*. Lösung Nr. 1 besteht aus 2
g rotem Blutlaugensalz und 2,5 g Ammoniumeisen(III)-citrat in 50 ml
Wasser. |
 |
||||||||||||||||||||||||||||||
|
Arbeitsaufträge
(schriftlich zu bearbeiten!): Werte die Versuche aus (in
tabellarischer Form): 1. In welcher Form ist Energie bei jedem der Versuche beteiligt? 2. Sind jeweils die Edukte oder die Produkte aus den Versuchen 1-5 energiereicher? Begründe mit Hilfe der Beobachtungen! (E>P: Edukte energiereicher als Produkte bzw. umgekehrt) |
|||||||||||||||||||||||||||||||
3. Vergleiche die Reaktion von Eisen und Schwefel und die Reaktion von Wasser mit weißem Kupfersulfat hinsichtlich der Energiebeteiligung. Stelle Gemeinsamkeiten und Unterschiede fest! 4. Vergleiche die Versuche mit den Aussagen im Buch S. 51. Kläre für dich folgende Begriffe: exotherm, endotherm, Energieumsatz, Energiediagramm; |
|||||||||||||||||||||||||||||||