|
|||||||||||||||||||||
Die Masse der Stoffe und die chemische Reaktion |
|||||||||||||||||||||
|
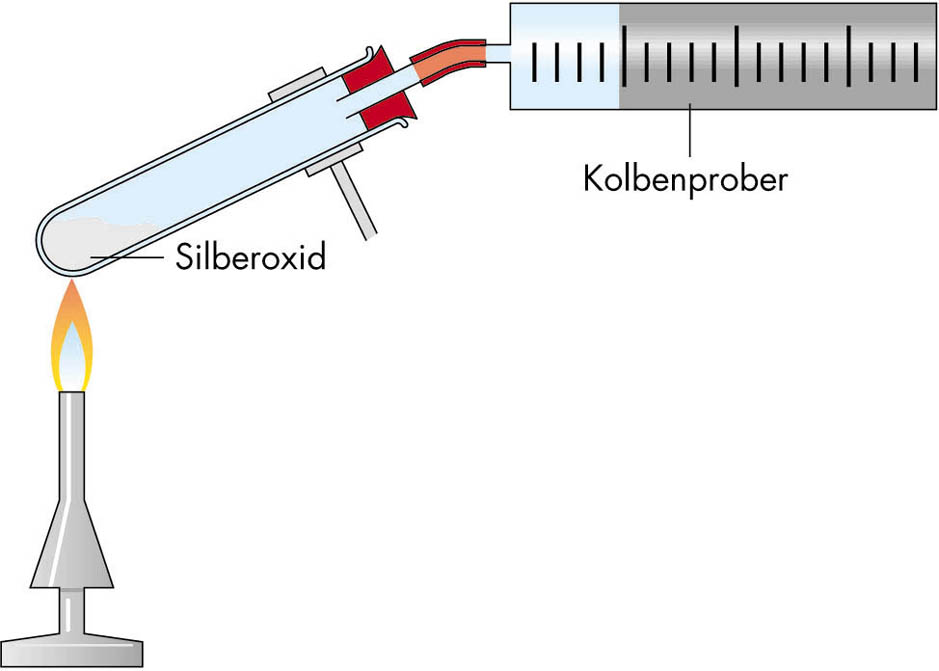
Versuch:
In einem Reagenzglas wird eine genau abgewogene Stoffportion
schwarzen Silberoxids langsam erhitzt und das entstehende Gas in einem
Kolbenprober aufgefangen. _________________________________________________________________ _________________________________________________________________ Mit dem Gas wird anschließend in einem kleinen Reagenzglas die Glimmspanprobe gemacht. Ergebnis: _______________________________________________________ Für die
Deutung
der Reaktion müssen zwei Fragen
beantwortet werden: 1. Zu welcher Gruppe von Metallen gehört Silber?
2. Ist die Zerlegung eine exotherme oder endotherme Reaktion? wird in einer ______________________ Reaktion in ____________________ und ______________ _____________ zerlegt. Der Vorgang ist einen ____________________ . Da Silber als ___________________nur ein ganz geringes _____________ zu Sauerstoff hat, lässt sich Silberoxid leicht in einer _____________________Reaktion in die __________________ Silber und Sauerstoff zerlegen. Messergebnisse: 3 = ___ - ___ ; 6 = ___ - ___ ; 7 = ___ - ___ ;
Ergebnis: _________________________________________________________________________________________________________ __________________________________________________________________________________________________________________ Allgemein gilt: Vergleicht man die _____________ der Massen der ___________________________ mit der Summe der ________ der _________________, stellt man fest, dass die Massen sich _____________________ ____________________ .
Arbeitsaufträge-Fragen: |