|
|||
Metalle reagieren mit Sauerstoff |
|||
|
Ein Holzspan glimmt an der Luft. In reinem Sauerstoff dagegen flammt er auf. Offensichtlich verläuft die Verbrennung in reinem Sauerstoff heftiger als an der Luft.
Wortliste: Eisenwolle, verbrennen, weiß, Sauerstoff, Verbrennungsprodukt Magnesiumband, verglühen, Funkensprühen; Rauch, Reaktionsschemata: Eisen + ________________ (g) ----> Eisenoxid (s) + ______________ Magnesium (s) + Sauerstoff (g) -----> __________________ (s) + ________ Zur Kennzeichnung der __________________________ werden die Stoffe mit
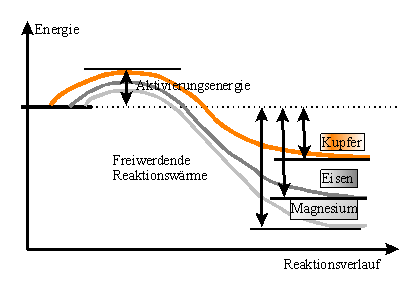
folgenden Kurzzeichen (in ( ) hinter dem Symbol oder Namen versehen: Oxide unterscheiden sich deutlich von den Metallen, aus denen sie entstanden sind. In der Regel sind sie ________, haben ________ ____________ - und ___________________ und werden vielfach als Farbpigmente verwendet. (siehe Tabelle) Allgemein gilt für die Reaktion zwischen einem Metall oder Nichtmetall und Sauerstoff das Reaktionsschema: Metall/Nichtmetall + Sauerstoff -----> Metall-__________ bzw. Nichtmetall____________ + ___________ . Bei den Oxidationsreaktionen wird (nach einer geringen Aktivierung) Energie in Form von ___________ und ________________ frei, deswegen sind die meisten Oxidationsreaktionen _________________________ Reaktionen. Das Bindungsbestreben: Bei den bisher beobachteten Reaktionen der Metalle Eisen, Kupfer und Magnesium haben diese unterschiedlich _______________________ mit Sauerstoff reagiert. Reagieren jedoch diese Metalle mit dem gleichen _____________________ (z.B. gleiche Korngröße bei den Pulvern), zeigen sich deutliche Unterschiede in der Helligkeit der Flamme und damit in der Heftigkeit der Reaktion. Von allen untersuchten Metallen hat Magnesium die größte _____________ _____ _____________ und damit das größte _______________________ zu Sauerstoff, und Kupfer das geringste. D.h.: von Kupfer über Eisen zu Magnesium nimmt das _________________ ___ ______ zu. Metalle, die ein großes ________ __________________ zu Sauerstoff haben, sind __________________ Metalle, _____________ metalle haben dagegen nur ein geringes bis gar kein ________________________ zu Sauerstoff. Arbeitsaufträge: 1. Stelle in einem Energiediagramm die unterschiedliche
Reaktionsheftigkeit der drei Metalle dar. |
|
Lösungen: |
|
Wortlisten in der Reihenfolge der Verwendung im Text:
Versuch: Eisenwolle, Magnesiumband, Sauerstoff; Beobachtung: verglüht, verbrennt, Funkensprühen, Reaktionsprodukt, weißen Rauches; Eine Reaktion,.... Sauerstoff, Oxidation, Oxide; Reaktionsschemata: Eisen + Sauerstoff (g) ----> Eisenoxid (s) + Wärme Magnesium (s) + Sauerstoff (g) -----> Magnesiumoxid (s) + Wärme/Licht Aggregatzustände, fest, hohe Schmelz- und Siedetemperaturen; Metall/Nichtmetall + Sauerstoff -----> Metalloxid bzw. Nichtmetalloxid + Wärme/Licht; Wärme und Licht; exotherme R. Das Bindungsbestreben: heftig, Zerteilungsgrad, Heftigkeit der Reaktion, Bindungsbestreben; Bindungsbestreben zu Sauerstoff, großes Bindungsbestreben, unedle, Edelmetalle, Bindungsbestreben; |
|
Arbeitsaufträge: 1. Stelle in einem Energiediagramm die unterschiedliche Reaktionsheftigkeit der drei Metalle dar.
|
|
2. Warum kommen die Edelmetalle
(welche sind das?) in der Natur "gediegen" vor?
Gold und Silber als Edelmetalle und Kupfer als Halbedelmetall haben nur ein geringes bis gar kein Bindungsbestreben zu Sauerstoff, deswegen kommen sie in der Natur rein ("gediegen") vor. Platin als Edelmetall muss aus seinen Verbindungen gewonnen werden. |
update am: 28.01.21 zurück zur Hauptseite