Auswertung: (im Ordner)
1. Durch Mischen von Sand und Salz haben wir uns zerkleinertes
Steinsalz selbst hergestellt. Beschreibe und erläutere, wie man Sand und
Salz wieder trennen kann.
Sand ist in Wasser
unlöslich, Salz nicht. Aufgrund der unterschiedlichen Löslichkeit lassen
sich beide Komponenten trennen.
2. Erkläre, auf welchen Eigenschaften die Trennung von Sand, Salz
und Wasser beruht.
Die Eigenschaften Unlöslichkeit und größere Dichte
(Sand), Löslichkeit und höherer Siedepunkt (Salz) und
niedrigerer Siedepunkt (Wasser) ermöglichen die Trennung.
3. Erläutere die Beobachtungen bei V6.
Das Wasser kondensiert im Glasrohr, Kühlmittel ist das Glasrohr und
die umgebende Luft. Sobald das Glasrohr die gleiche Temperatur wie der
Wasserdampf hat, gibt es keine Kondensation mehr.
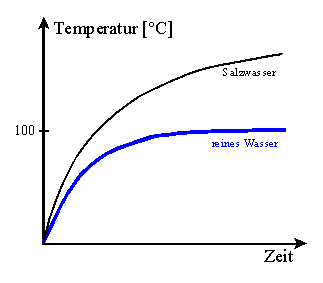
4. Notiere die bei V7 gemessenen Siedetemperatur und zeichne eine
Siedekurve (y-Ache: Temperatur, x-Achse: Zeit). Vergleiche diese Kurve
mit der Siedekurve von reinem Wasser. Fertige vor dem Versuch eine
Messwerte-Tabelle an für einen Zeitraum von ca. 5 Minuten ( = 10
Messpunkte).
 |