|
||
Das Standard-Potential |
||
| Aus den Versuchen
im AB „Spannungsmessungen an einfachen galvanischen Elementen"
geht hervor:
1. Die Metall-/Metallionen-Kombination (das _________________ )
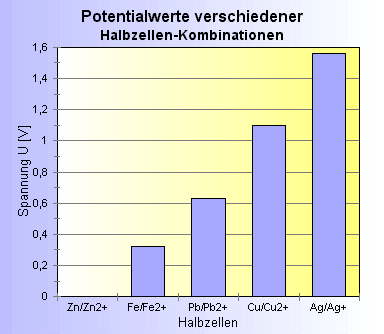
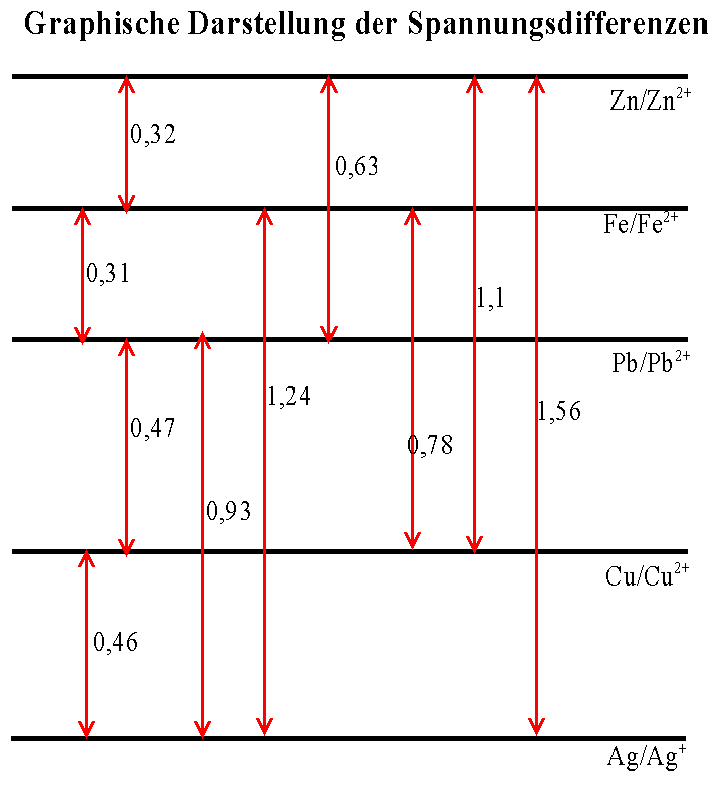
_____ / ____ 3. Eine etwas differenziertere Darstellung erhält man, wenn die (wieder idealtypischen) Werte aller Kombinationen dargestellt werden. Daraus wird ersichtlich, dass die Spannungsdifferenzen z.B. zwischen Fe/Fe2+ und Pb/Pb2+ bzw. Pb/Pb2+ und Cu/Cu2+ sich additiv verhalten: sie sind ebenso groß wie die Differenz zwischen Fe/Fe2+ und Cu/Cu2+ selbst (Abb.2.) |
 |
|
|
|
 |
|
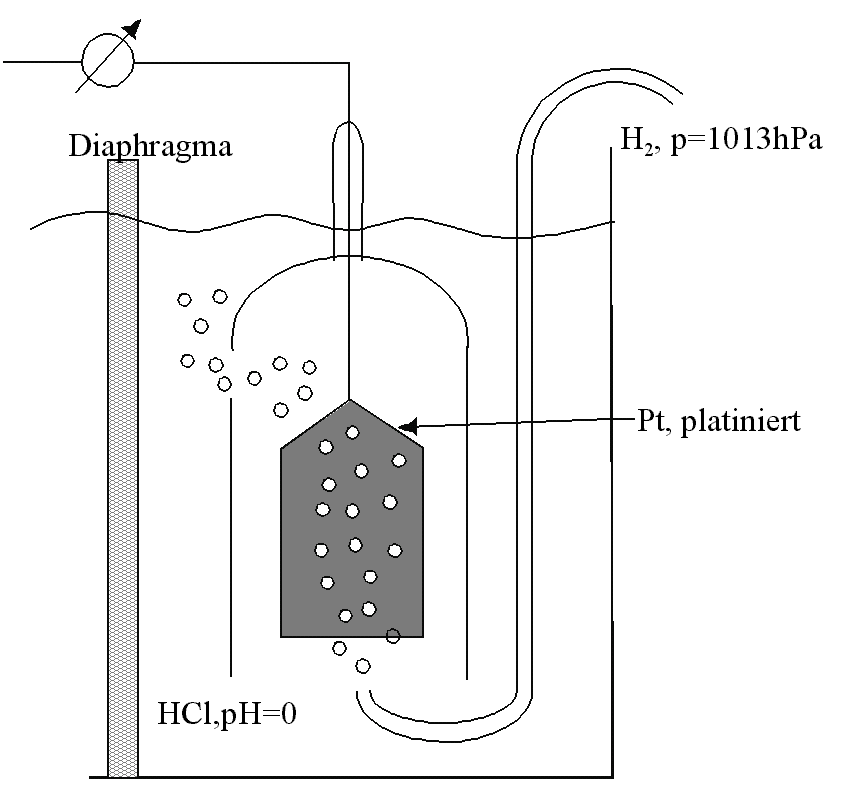
| Technisch gesehen besteht die Standard-Wasserstoff-Elektrode aus einem platinierten Pt-Blech (sog. Platin-„Mohr" [Vergrößerung der Oberfläche]), das in eine Salzsäure-Lösung der Konzentration c(H3O+) = 1 mol/L (pH = 0) getaucht ist. Dabei wird die Pt-Oberfläche von H2-Gas umspült, das unter einem Druck von 1,013 bar gegen die Elektrode sprudelt. Die Spannungen oder Potentialdifferenzen, die andere Metall-/Metallionen- oder Nichtmetallionen- /Nichtmetall- Kombinationen gegen diese Standard-Wasserstoff-Elektrode aufweisen, werden als Standardpotentiale E° bezeichnet (Standardbedingungen: Aktivität a=1 mol und Temperatur = 25 °C) [Aktivität ~ Konzentration]. |
 |
|
|
update am: 02.02.21 zurück zur Hauptseite |